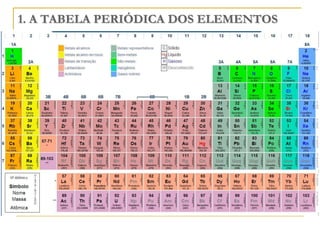
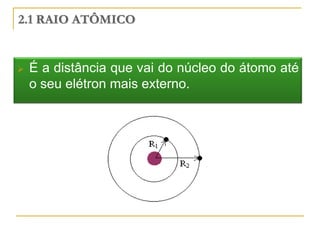
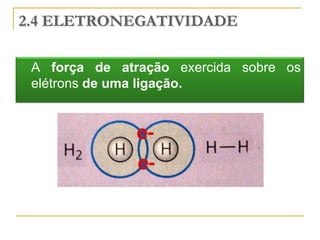
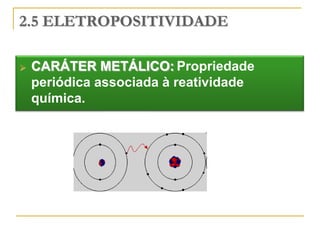
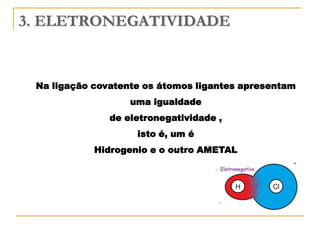
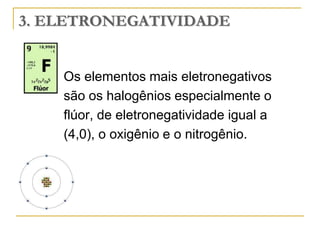
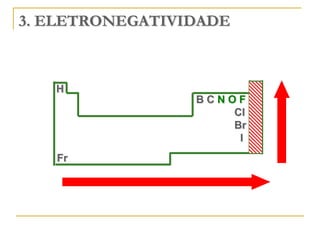
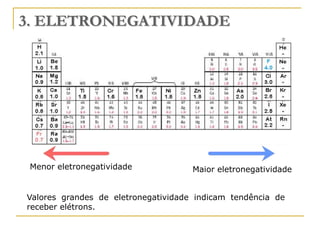
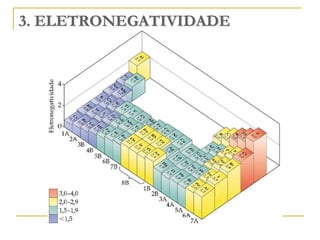
O documento discute as propriedades periódicas dos elementos, incluindo eletronegatividade. Explica que eletronegatividade é a capacidade de um átomo atrair elétrons em uma ligação química e varia periodicamente na tabela periódica, com elementos mais à direita e acima sendo mais eletronegativos. Também discute como eletronegatividade afeta os tipos de ligação, com diferenças grandes de eletronegatividade resultando em ligações iônicas e diferenças pequenas resultando em liga