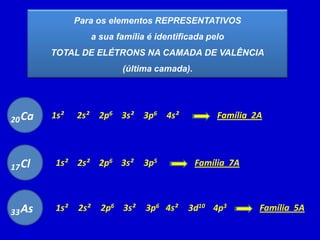
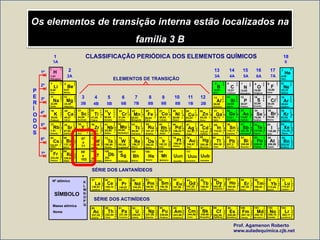
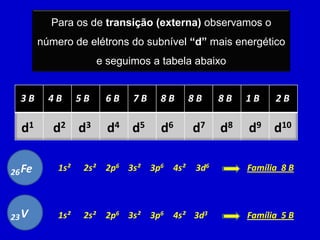
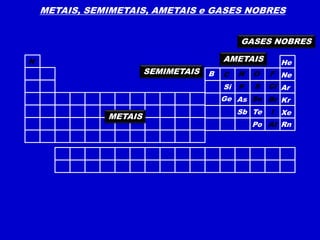
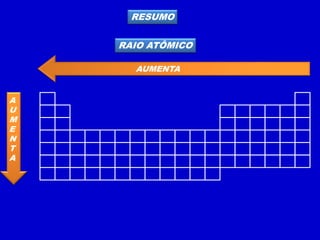
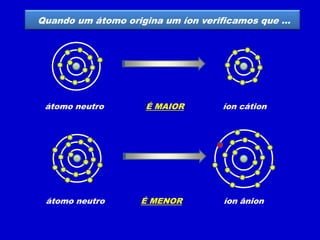
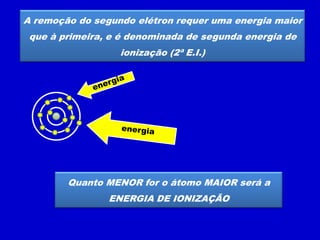
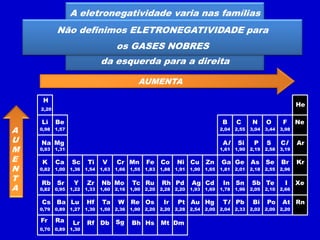
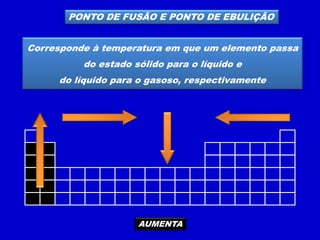
O documento descreve as características dos períodos e famílias da tabela periódica. Os períodos são as linhas horizontais e indicam o número de níveis eletrônicos dos elementos. As famílias são as colunas verticais e indicam o número total de elétrons na camada de valência. Os elementos representativos possuem o elétron diferencial em subníveis s ou p, enquanto os de transição o possuem em subníveis d ou f.