1. O documento aborda cálculos de solubilidade relacionando-a com o produto de solubilidade, Kps. É apresentado o método das aproximações sucessivas para calcular a solubilidade em situações mais complexas.
2. São calculadas as solubilidades de vários sais considerando apenas o equilíbrio de dissociação. A solubilidade depende do valor de Kps em cada caso.
3. A solubilidade do SrSO4 é calculada em várias condições, considerando o equilíbrio com soluções de Sr(NO3)
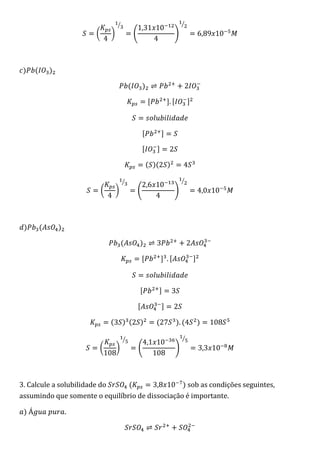
![Nessa terceira lista abordamos cálculos de solubilidade relacionando-a com o produto de solubilidade, Kps, finalizando mais uma vez com o método das aproximações sucessivas para questões mais elaboradas.<br />1. Assumindo que no equilíbrio de dissociação estão envolvidos apenas os precipitados a seguir, escreva o Kps como função de sua solubilidade.<br />a) AgSCN<br />R.:Kps=S2<br />b) PbCrO4<br />R.:Kps=S2<br />c) PbI2<br />R.:Kps=4S3<br />d) PbClF<br />R.:Kps=S3<br />e) Ce2S3<br />R.:Kps=108S5<br />2. Assumindo que no equilíbrio de dissociação estão envolvidos apenas os precipitados a seguir, calcular a solubilidade molar de cada um em água.<br />a)PbSO4<br />R.:1,3x10-5M<br />b)Ag2CrO4<br />R.:6,89x10-5M<br />c)Pb(IO3)2<br />R.:4,0x10-5M<br />d)Pb3(AsO4)2<br />R.:3,3x10-8M<br />3. Calcule a solubilidade do SrSO4 (Kps=3,8x10-7) sob as condições seguintes, assumindo que somente o equilíbrio de dissociação é importante.<br />a) Água pura.<br />R.:6,2x10-4M<br />b) 0,0010M de Sr(NO3)2.<br />R.:2,9x10-4M<br />c) 0,010M de Sr(NO3)2.R.:3,8x10-5M<br />d) 0,10M de Sr(NO3)2.<br />R.:3,8x10-6M<br />4. Calcular a solubilidade do Ag2CrO4 (Kps=1,31x10-12) sob as condições abaixo, considerando importante somente o equilíbrio de dissociação:<br />a) Água pura.<br />R.:6,89x10-2M<br />b) 0,0100M de Ag(NO3).<br />R.:1,31x10-8M<br />c) 0,0100M de Na2CrO4.R.:5,72x10-6M<br />SOLUÇÕES<br />1. Assumindo que no equilíbrio de dissociação estão envolvidos na dissolução apenas os precipitados a seguir, escreva o Kps como função de sua solubilidade.<br />a) AgSCN<br />AgSCN⇌Ag++SCN-<br />S=solubilidade<br />S=(nº de mols de precipitado que dissolvem por litro de solução)<br />Como temos 1 mol de prata em cada mol de tiocianato de prata:<br />(nº de mols de precipitado que dissolve por litro de solução)=(nº de mols de Ag+ por litro de solução)<br />ou<br />S=[Ag+]<br />Como existe um mol de tiocianato em cada mol de tiocianato de prata:<br />(nº de mols de precipitado que dissolve por litro de solução)=(nº de mols de SCN- por litro de solução)<br />ou <br />S=[SCN-]<br />Kps=Ag+.SCN-=S.S=S2<br />b) PbCrO4<br />PbCrO4⇌Pb2++CrO42-<br />S=solubilidade<br />S=(nº de mols de precipitado que dissolvem por litro de solução)<br />Como temos 1 mol de chumbo para cada mol de cromato de chumbo:<br />(nº de mols de precipitado que dissolve por litro de solução)=(nº de mols de Pb2+ por litro de solução)<br />ou<br />S=[Pb2+]<br />Como existe um mol de cromato em cada mol de cromato de chumbo:<br />(nº de mols de precipitado que dissolve por litro de solução)=(nº de mols de CrO42- por litro de solução)<br />ou<br />S=[CrO42-]<br />Kps=Pb2+.CrO42-=S.S=S2<br />c) PbI2<br />PbI2⇌Pb2++2I-<br />S=solubilidade<br />S=(nº de mols de precipitado que dissolvem por litro de solução)<br />Como temos 1 mol de chumbo para cada mol de iodeto de chumbo:<br />(nº de mols de precipitado que dissolve por litro de solução)=(nº de mols de Pb2+ por litro de solução)<br />ou<br />S=[Pb2+]<br />Como existem 2 mols de iodeto em cada mol de iodeto de chumbo:<br />(2)(nº de mols de precipitado que dissolve por litro de solução)=(nº de mols de I- por litro de solução)<br />ou<br />2S=[I-]<br />Kps=Pb2+.I-2=S.2S2=4S3<br />d) PbClF<br />PbClF⇌Pb2++Cl-+F-<br />S=solubilidade<br />S=(nº de mols de precipitado que dissolvem por litro de solução)<br />Como temos 1 mol de chumbo para cada mol de PbClF:<br />(nº de mols de precipitado que dissolve por litro de solução)=(nº de mols de Pb2+ por litro de solução)<br />ou<br />S=[Pb2+]<br />Como existe um mol de cloreto em cada mol de PbClF:<br />(nº de mols de precipitado que dissolve por litro de solução)=(nº de mols de Cl- por litro de solução)<br />ou<br />S=[Cl-]<br />Como existe um mol de fluoreto em cada mol de PbClF:<br />(nº de mols de precipitado que dissolve por litro de solução)=(nº de mols de F- por litro de solução)<br />ou<br />S=[F-]<br />Kps=Pb2+.Cl-.F-=S.S.(S)=S3<br />e) Ce2S3<br />Ce2S3⇌2Ce3++3S2-<br />S=solubilidade<br />S=(nº de mols de precipitado que dissolvem por litro de solução)<br />Como temos 2 mols de cério para cada mol de sulfito de cério:<br />(2)(nº de mols de precipitado que dissolve por litro de solução)=(nº de mols de Ce3+ por litro de solução)<br />ou<br />2S=[Ce3+]<br />Como existem 3 mols de sulfito em cada mol de sulfito de cério:<br />(3)(nº de mols de precipitado que dissolve por litro de solução)=(nº de mols de CrO42- por litro de solução)<br />ou<br />3S=[S2-]<br />Kps=Ce3+.S2-=2S2.3S3=(4S2).27S2=108S5<br />2. Assumindo que no equilíbrio de dissociação estão envolvidos na dissolução apenas os precipitados a seguir, calcular a solubilidade molar de cada um em água.<br />a)PbSO4<br />PbSO4⇌Pb2++SO42-<br />Kps=Pb2+.SO42-<br />S=solubilidade<br />Pb2+=S<br />SO42-=S<br />Kps=SS=S2<br />S=(Kps)12=(1,6x10-10)12=1,3x10-5M<br />b)Ag2CrO4<br />Ag2CrO4⇌2Ag++CrO42-<br />Kps=Ag+2.CrO42-<br />S=solubilidade<br />Ag+=2S<br />CrO42-=S<br />Kps=2S2S=4S3<br />S=Kps413=1,31x10-12412=6,89x10-5M<br />c)Pb(IO3)2<br />Pb(IO3)2⇌Pb2++2IO3-<br />Kps=[Pb2+].IO3-2<br />S=solubilidade<br />Pb2+=S<br />IO3-=2S<br />Kps=S2S2=4S3<br />S=Kps413=2,6x10-13412=4,0x10-5M<br />d)Pb3(AsO4)2<br />Pb3(AsO4)2⇌3Pb2++2AsO43-<br />Kps=[Pb2+]3.AsO43-2<br />S=solubilidade<br />Pb2+=3S<br />AsO43-=2S<br />Kps=3S32S2=(27S3). (4S2)=108S5<br />S=Kps10815=4,1x10-3610815=3,3x10-8M<br />3. Calcule a solubilidade do SrSO4 (Kps=3,8x10-7) sob as condições seguintes, assumindo que somente o equilíbrio de dissociação é importante.<br />a) Água pura.<br />SrSO4⇌Sr2++SO42-<br />Kps=Sr2+.SO42-<br />S=solubilidade<br />Sr2+=S<br />SO42-=S<br />Kps=SS=S2<br />S=(Kps)12=(3,8x10-7)12=6,2x10-4M<br />b) 0,0010M de Sr(NO3)2.<br />S=solubilidade<br />SO42-=S<br />Mas Sr2+≠S. Por quê?<br />Existem duas formas de se encontrar íons estrôncio, o precipitado SrSO4 e em uma solução de Sr(NO3)2.<br />(concentração de Sr2+do SrSO4)=Sr2+ppt<br />Sr2+ppt=SO42-=S<br />concentração de Sr2+do Sr(NO3)2=0,0010 M<br />Sr2+=(concentração de Sr2+do SrSO4)+ (concentração de Sr2+do Sr(NO3)2)=Sr2+ppt+0,0010=S+1,0x10-3<br />Kps=Sr2+.SO42-<br />Kps= S+1,0x10-3S<br />S=KpsS+1,0x10-3<br />Primeira aproximação:<br />S'=Kps1,0x10-3=3,8x10-71,0x10-3=3,8x10-4M<br />Segunda aproximação:<br />S''=Kps1,0x10-3+S'=3,8x10-71,0x10-3+3,8x10-4=2,8x10-4M<br />S’ e S’’ não são iguais.<br />Terceira aproximação:<br />S'''=Kps1,0x10-3+S''=3,8x10-71,0x10-3+2,8x10-4=3,0x10-4M<br />Quarta aproximação:<br />S''''=Kps1,0x10-3+S'''=3,8x10-71,0x10-3+3,0x10-4=2,9x10-4M<br />Quinta aproximação:<br />S'''''=Kps1,0x10-3+S''''=3,8x10-71,0x10-3+2,9x10-4=2,9x10-4M<br />S’’’’ e S’’’’’ são iguais.<br />c) 0,010M de Sr(NO3)2.<br />Utilizando o mesmo procedimento do item b:<br />S=Kps10-2+S<br />Primeira aproximação:<br />S'=Kps1,0x10-2=3,8x10-71,0x10-2=3,8x10-5M<br />Segunda aproximação:<br />S''=Kps1,0x10-2+S'=3,8x10-71,0x10-2+3,8x10-5=3,8x10-5M<br />S’ e S’’ são iguais.<br />d) 0,10M de Sr(NO3)2.<br />Novamente com no item b:<br />S=Kps10-1+S<br />Primeira aproximação:<br />S'=3,8x10-71,0x10-1=3,8x10-6M<br />Segunda aproximação:<br />S''=Kps10-1+S'=3,8x10-71,0x10-1+3,8x10-6=3,8x10-6M<br />Novamente S’ e S’’ convergem em duas aproximações.<br />4. Calcular a solubilidade do Ag2CrO4 (Kps=1,31x10-12) sob as condições abaixo, considerando importante somente o equilíbrio de dissociação:<br />a) Água pura.<br />Lembra-se do problema 2 item b? Dele,<br />S=Kps413=1,31x10-12412=6,89x10-5M<br />b) 0,0100M de Ag(NO3).<br />Ag2CrO4⇌2Ag++CrO42-<br />S=solubilidade<br />CrO42-=S<br />Mas Ag+≠2S. Por quê?<br />Existem duas formas de íon prata, o precipitado Ag2CrO4 e o AgNO3 em solução.<br />concentração de Ag+do Ag2CrO4=Ag+ppt<br />Ag+ppt=2CrO42-=2S<br />concentração de Ag+do AgNO3=0,0100M<br />Ag+=concentração de Ag+do Ag2CrO4+concentração de Ag+do AgNO3=(Ag+)ppt+0,0100=2S+1,00x10-2<br />Kps=Ag+2.CrO42-=2S+1,00x10-22.(S)<br />S=Kps2S+1,00x10-22<br />Primeira aproximação:<br />S'=Kps2S+1,00x10-22=1,31x10-122S+1,00x10-22=1,31x10-8M<br />Segunda aproximação:<br />S''=Kps[(2)(1,31x10-8)+1,00x10-2]2=1,31x10-8M<br />Note a rápida convergência de S’ e S’’.<br />c) 0,0100M de Na2CrO4.<br />Ag2CrO4⇌2Ag++CrO42-<br />S=solubilidade<br />Ag+=2S<br />Mas CrO42-≠S. Por quê?<br />Existem duas formas de íon prata, o precipitado Ag2CrO4 e o Na2CrO4 em solução.<br />concentração de CrO42-do Ag2CrO4=CrO42-ppt<br />CrO42-ppt=12Ag+=122S=S<br />concentração de CrO42-do Na2CrO4 =0,0100M<br />CrO42-=concentração de CrO42-do Ag2CrO4+concentração de CrO42-do Na2CrO4=(CrO42-)ppt+0,0100=S+1,00x10-2<br />Kps=Ag+2.CrO42-=2S2.(S+1,00x10-2)<br />4S2=KpsS+1,00x10-2<br />S=Kps4S+4,00x10-212<br />Primeira aproximação:<br />S'=Kps4,00x10-212=1,31x10-124,00x10-212=5,72x10-6M<br />Segunda aproximação:<br />S''=Kps4S'+4,00x10-212=1,31x10-124(5,72x10-6)+4,00x10-212=5,72x10-6M<br />Note como S’ e S’’ convergem. Note também o grande efeito de uma solução 10-2M de AgNO3 tem em comparação com o efeito de 10-2M de Na2CrO4.<br />](https://image.slidesharecdn.com/lista3-solubilidadeekps-101227182946-phpapp01/75/Lista-3-solubilidade-e-kps-1-2048.jpg)