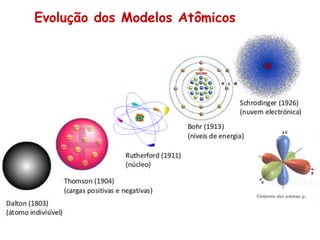
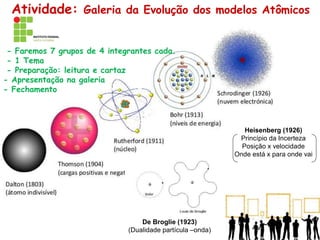
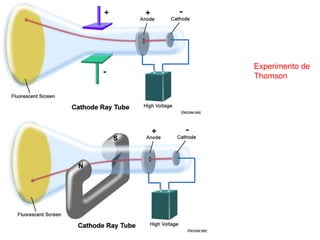
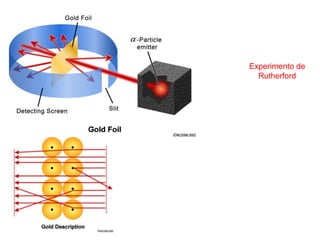
O documento discute a evolução dos modelos atômicos ao longo da história, desde os modelos iniciais de Demócrito e Dalton até os modelos atômicos modernos. Apresenta brevemente os principais modelos atômicos desenvolvidos por cientistas como Thomson, Rutherford, Bohr, De Broglie e Heisenberg, e como esses modelos foram sendo refinados com novos experimentos e descobertas. Também fornece exercícios sobre os conceitos-chave dos modelos atômicos.