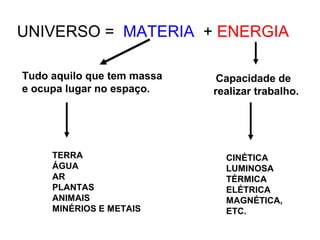
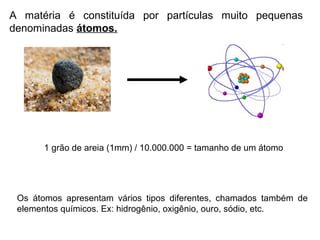
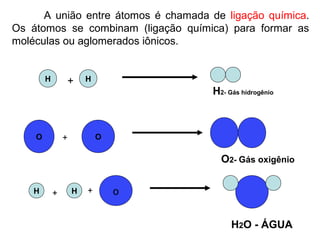
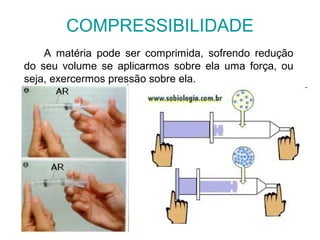
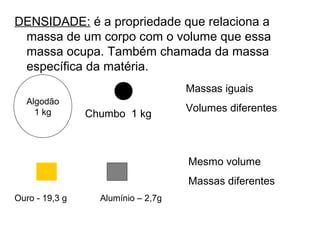
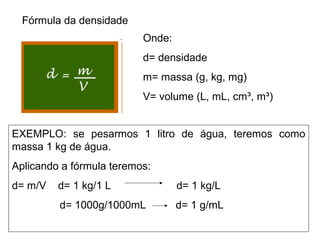
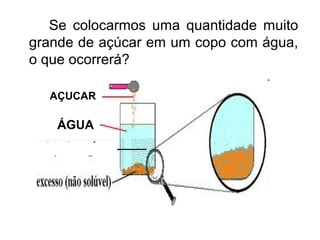
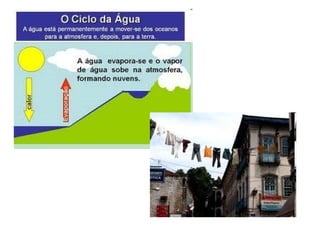
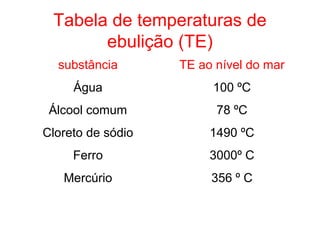
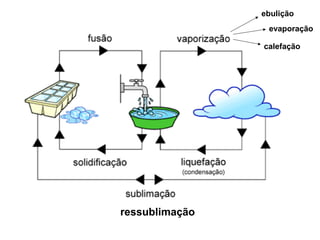
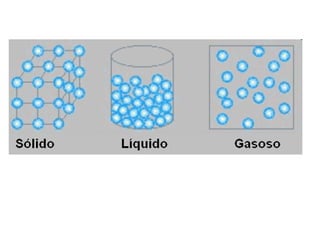
Este documento resume os principais conceitos de matéria e suas propriedades. Explica que a matéria é constituída por átomos que se combinam para formar moléculas e substâncias. Descreve as propriedades gerais da matéria como extensão, massa e impenetrabilidade, bem como as propriedades específicas como estado físico, densidade e solubilidade. Por fim, aborda os processos de mudança de estado físico como fusão, ebulição e sublimação.