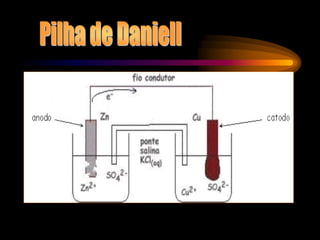
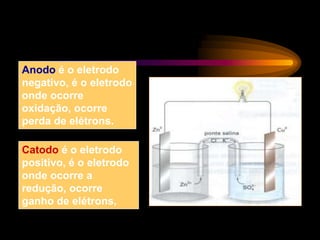
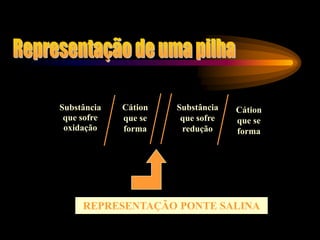
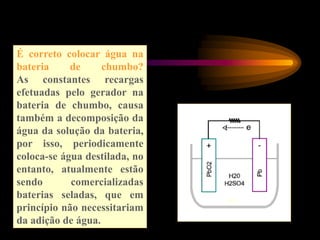
Pilhas e baterias convertem energia química em energia elétrica através de reações redox. A primeira pilha foi criada por Volta em 1800 usando discos de cobre e zinco separados por algodão úmido. Pilhas modernas como a de chumbo são recarregáveis, enquanto pilhas como a de Leclanché não são recarregáveis.