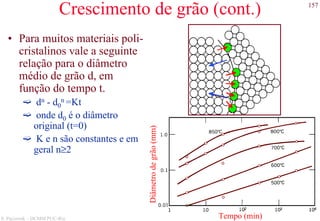
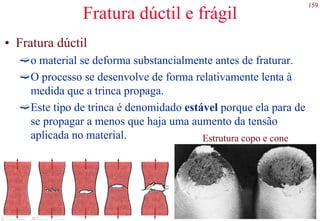
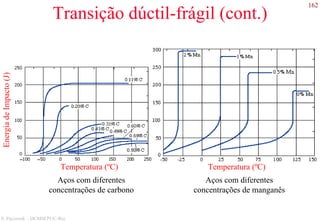
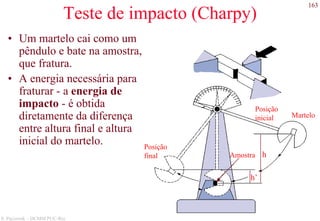
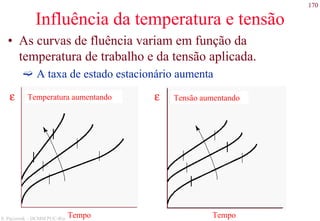
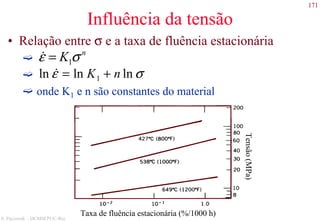
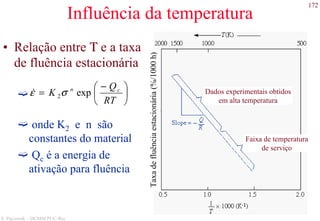
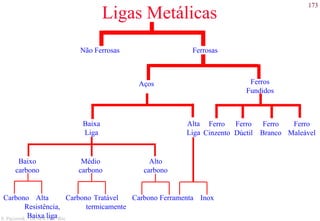
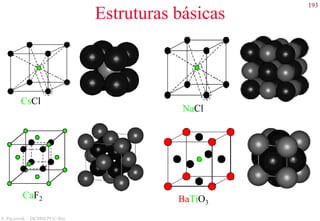
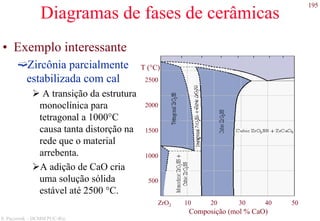
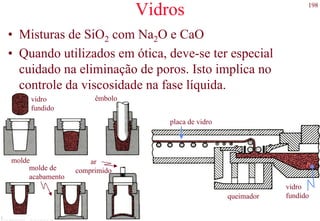
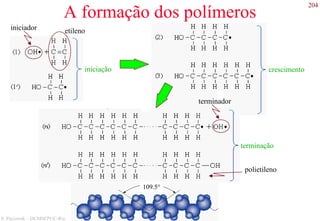
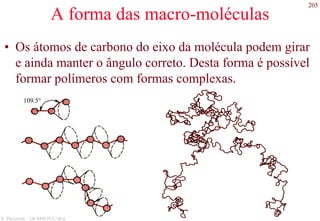
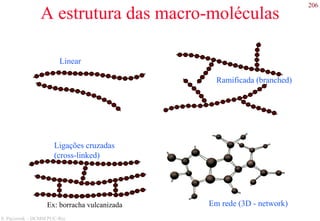
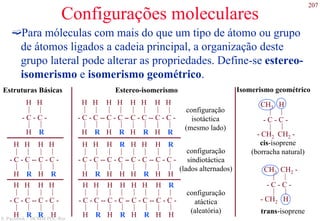
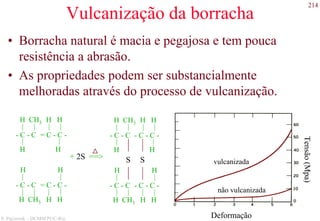
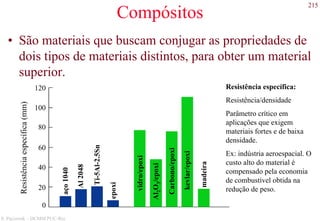
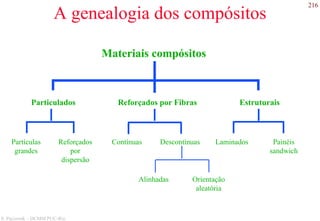
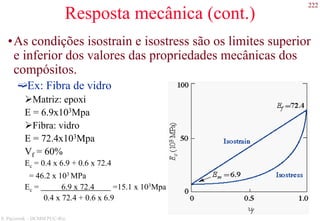
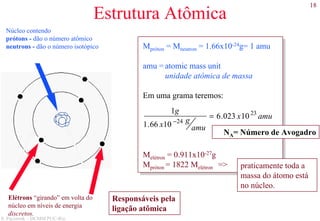
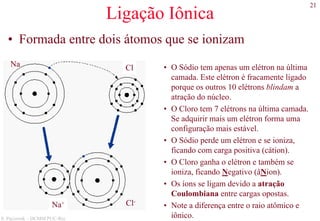
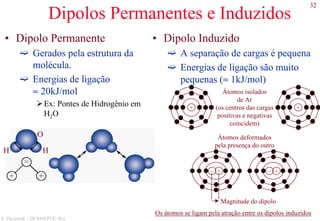
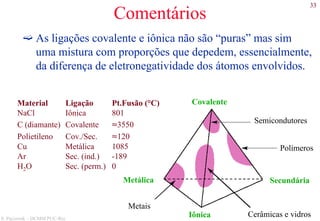
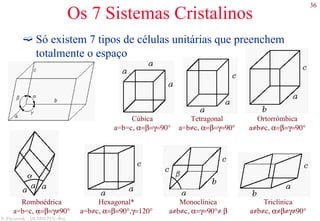
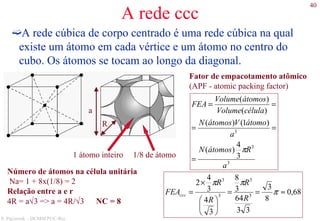
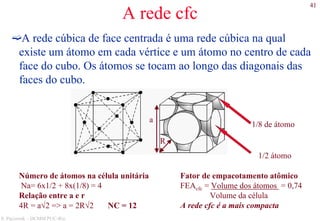
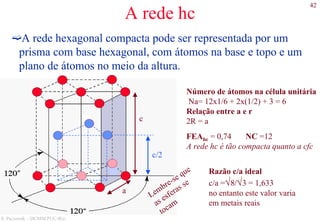
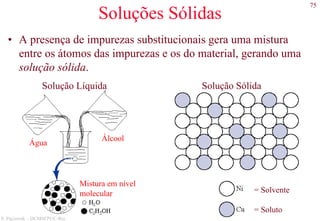
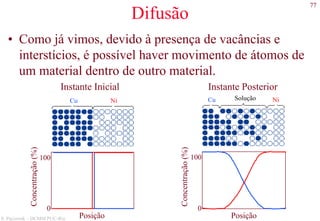
O documento apresenta os principais tipos de materiais - metais, cerâmicas, polímeros, compósitos e semicondutores. Descreve suas propriedades básicas e como são representados na tabela periódica. Também discute os conceitos de estrutura atômica, tipos de ligação química e como estas propriedades determinam as características macroscópicas dos materiais.




























![47
S. Paciornik – DCMM PUC-Rio
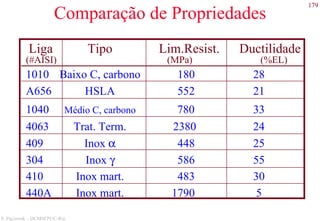
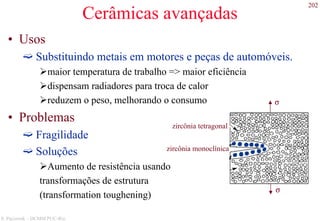
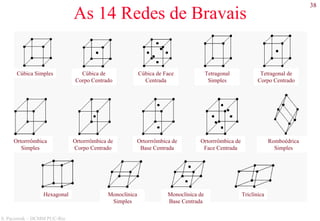
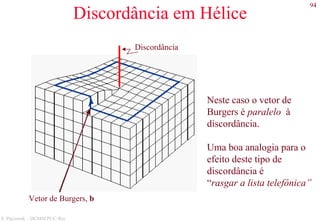
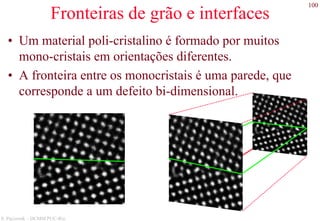
Direções cristalográficas
As direções são definidas a partir da origem.
Suas coordenadas são dadas pelos pontos que cruzam o
cubo unitário. Se estes pontos forem fraccionais multiplica-
se para obter números inteiros.
[1 1 1]
[1 -1 1]
1 1 1[ ]
[0 0 1]
[0 1 1/2]=[0 2 1]
[0 1 0]
[1/2 1 0]=[1 2 0]
[1 1 0]
[1 0 0]](https://image.slidesharecdn.com/cemat-200923005439/85/Cemat-47-320.jpg)
![48
S. Paciornik – DCMM PUC-Rio
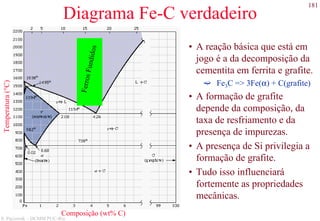
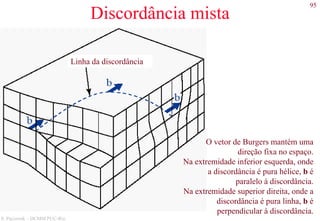
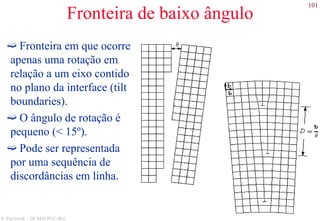
Direções cristalográficas (cont.)
• Famílias de direções
Formadas por posições semelhantes dentro da estrutura
cristalina.
<111> = [111],[111],[111],[111],[111],[111],[111],[111]
• Ângulo entre direções no sistema cúbico
Dado pelo produto escalar entre as direções, tratadas como
vetores.
r
D = u
r
a + v
r
b + w
r
c
r
D' = u'
r
a + v'
r
b + w'
r
c
r
D ⋅
r
D' =
r
D
r
D' cos θ
cos θ =
r
D ⋅
r
D'
r
D
r
D'
=
uu' +vv' +ww'
u2
+ v2
+ w2
u'2
+v' 2
+w' 2
Ex: [100] e [010]
Ex: [111] e [210]
0
222222
900
010001
001001
cos =⇒=
++++
⋅+⋅+⋅
= θθ
0
222222
2,39
5
3
012111
011121
cos =⇒=
++++
⋅+⋅+⋅
= θθ](https://image.slidesharecdn.com/cemat-200923005439/85/Cemat-48-320.jpg)
![49
S. Paciornik – DCMM PUC-Rio
Planos cristalográficos
• A notação para os planos utiliza os índices de Miller,
que são obtidos da seguinte maneira:
Obtém-se as intersecções do plano com os eixos.
Obtém-se o inverso das intersecções.
Multiplica-se para obter os menores números inteiros.
1/2
1
Intersecções: 1/2, ∞, 1
Inversos: 2, 0 ,1
Índices de Miller: (201)
Em sistemas cúbicos o plano (hkl)
é normal a direção [hkl]](https://image.slidesharecdn.com/cemat-200923005439/85/Cemat-49-320.jpg)
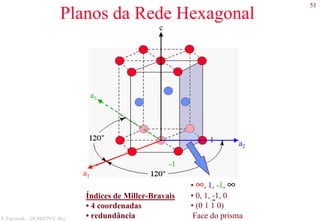
![52
S. Paciornik – DCMM PUC-Rio
Resumo
• Direções
[uvw]
• Famílias de direções
<uvw>
• Planos
(hkl) (índices de Miller)
Na hexagonal (hkil) (índices de Miller-Bravais)
i = - (h + k)
• Famílias de planos
{hkl}](https://image.slidesharecdn.com/cemat-200923005439/85/Cemat-52-320.jpg)
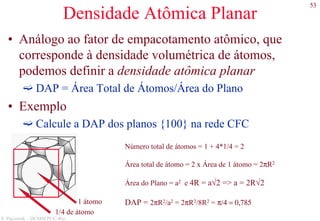



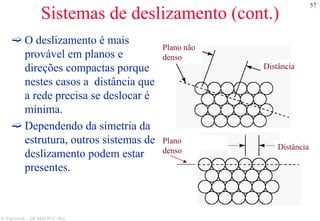
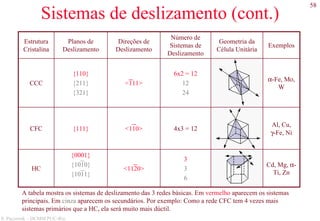


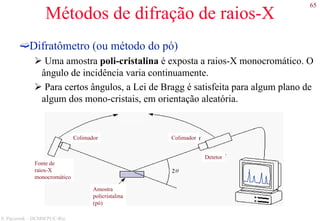
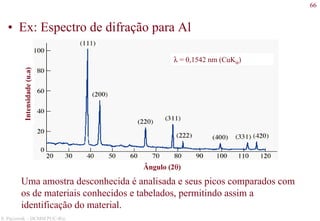



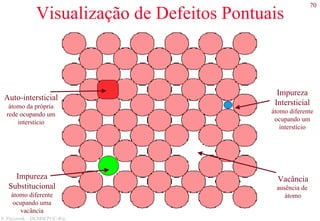



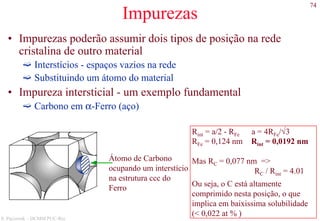

![78
S. Paciornik – DCMM PUC-Rio
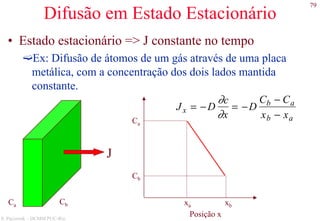
As leis de Fick
• 1ª Lei
O fluxo da impureza na direção x é proporcional ao
gradiente de concentração nesta direção.
Jx = −D
∂c
∂x
Jx = Fluxo de átomos através
da área A [átomos/m2.s]
D = coeficiente de difusão ou
difusividade [m2/s]](https://image.slidesharecdn.com/cemat-200923005439/85/Cemat-78-320.jpg)




















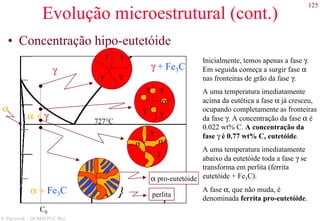
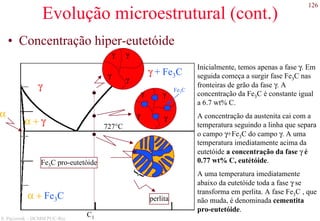
![127
S. Paciornik – DCMM PUC-Rio
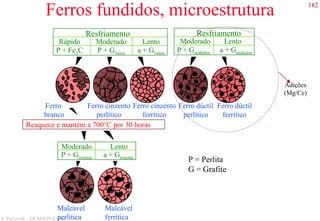
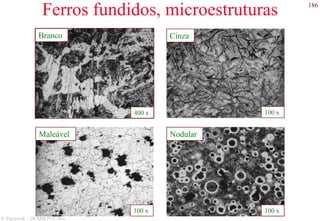
Exemplos de microestruturas
Aço hiper-eutetóide com 1.40 wt% C,
composto por cementita pro-eutetóide (fase
clara) e perlita. 1000x.
Aço hipo-eutetóide com 0.38 wt% C,
composto por ferrita pro-eutetóide (fase
clara) e perlita [fase com lamelas claras
(ferrita) e escuras (cementita)]. 635x.](https://image.slidesharecdn.com/cemat-200923005439/85/Cemat-127-320.jpg)