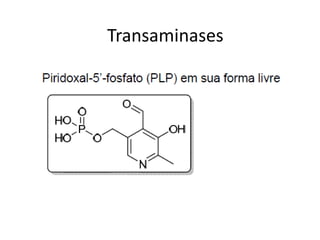
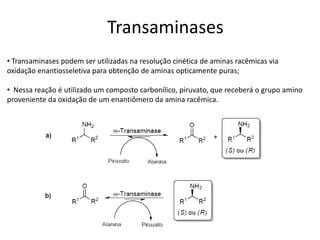
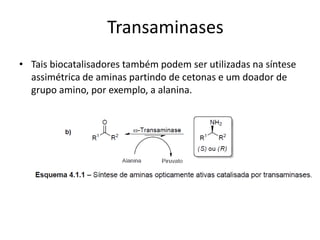
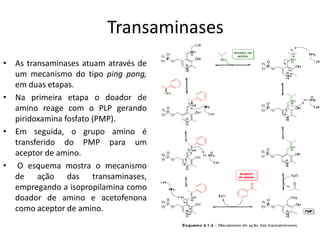
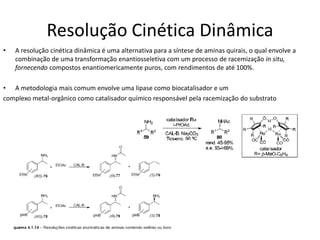
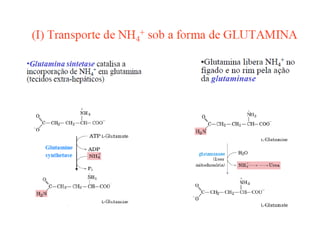
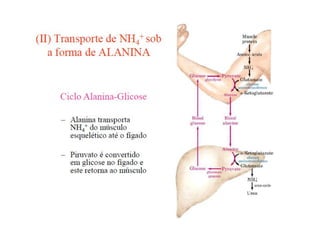
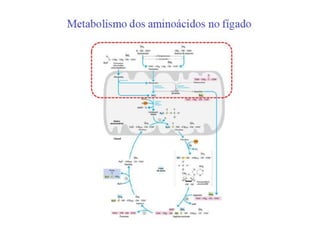
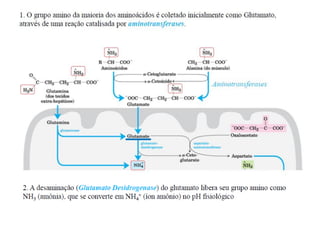
O documento discute transaminases, enzimas que catalisam a transferência reversível de grupos aminos entre aminoácidos. Especificamente:
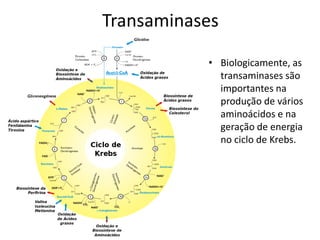
1) Transaminases são importantes na produção de aminoácidos e geração de energia no ciclo de Krebs.
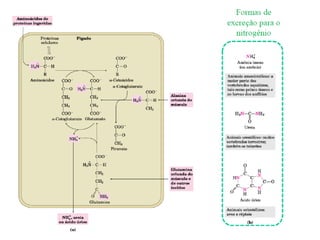
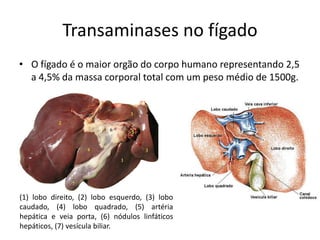
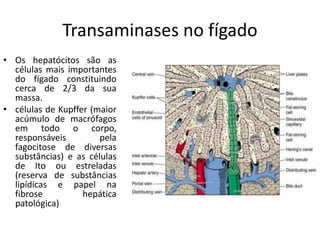
2) O fígado produz mais de 60 transaminases, sendo ALT e AST as mais relevantes clinicamente e úteis no diagnóstico de doenças hepáticas.
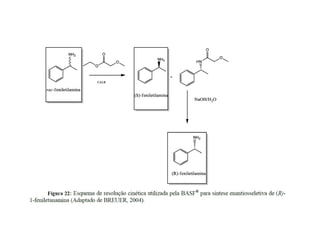
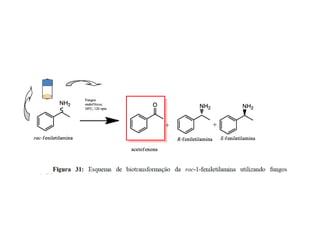
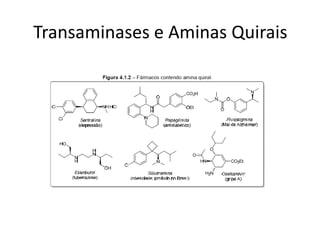
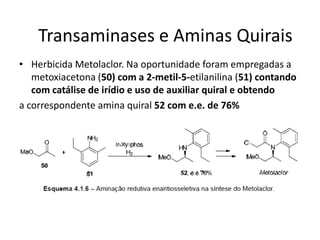
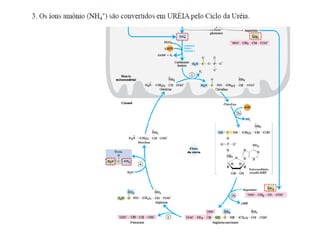
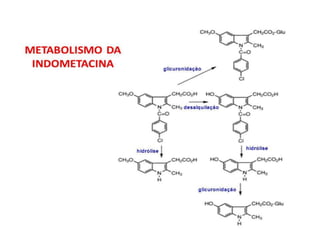
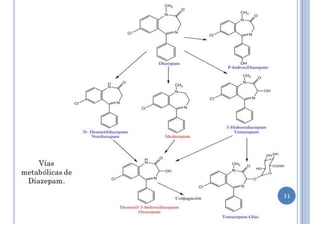
3) Transaminases podem ser usadas na síntese assimétrica de aminas quirais a partir de c


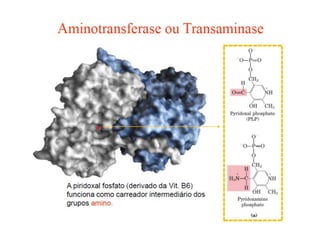





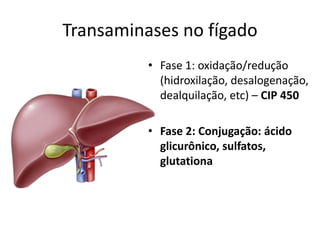
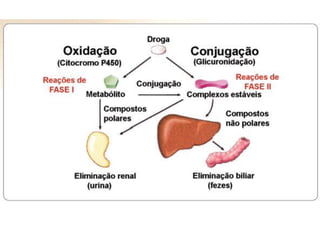
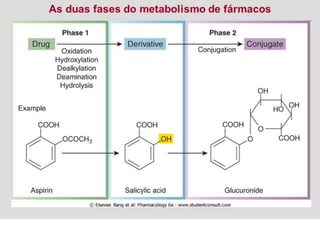
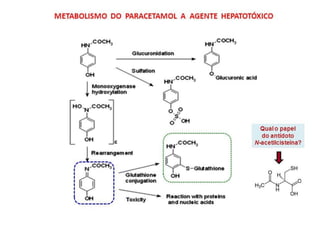

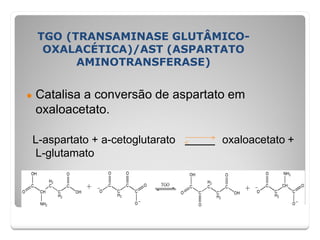






![TGP (TRANSAMINASE GLUTÂMICO-
PIRÚVICA)/ALT (ALANINA
AMINOTRANSFERASE)
● Catalisa a conversão de alanina em ácido pirúvico.
● Maiores concentrações: fígado, rim e em pequenas
quantidades no coração e na musculatura
esquelética.
● ↑ [ ] recém-nascidos: é atribuído à imaturidade dos
hepatócitos nos neonatos, que apresentam as
membranas celulares mais permeáveis. Os valores
se igualam aos níveis do adulto em torno dos 3
meses de idade.](https://image.slidesharecdn.com/aulatransaminases-210718093117/85/Aula-transaminases-33-320.jpg)