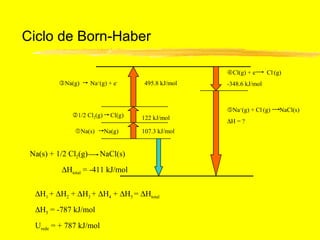
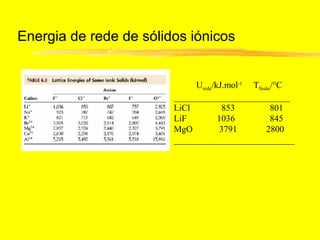
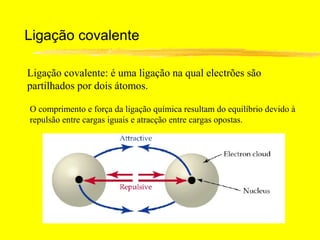
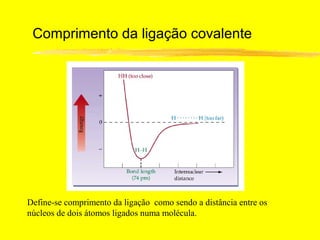
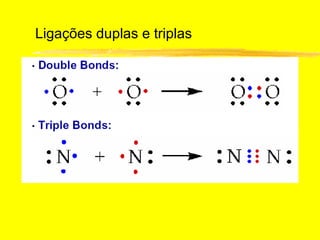
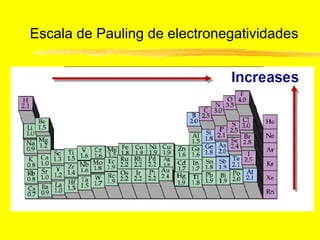
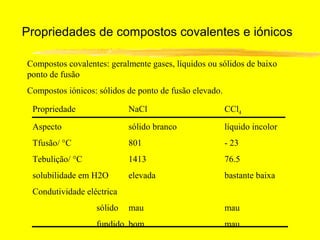
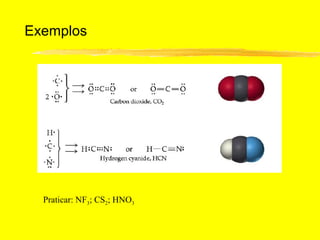
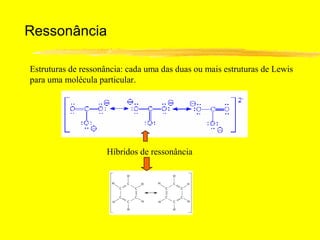
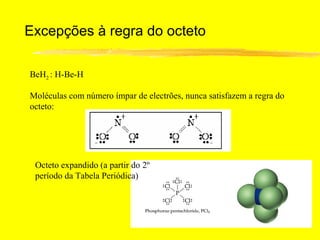
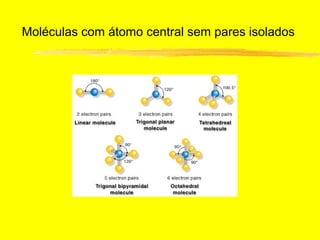
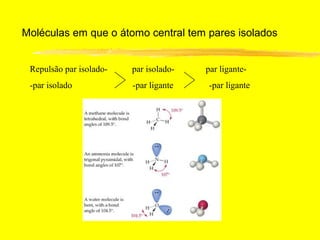
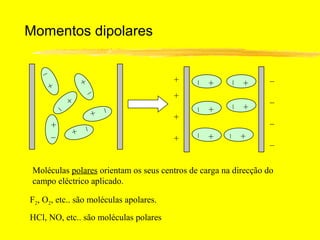
O documento discute os conceitos de ligação química. Explica que as ligações ocorrem quando átomos compartilham ou transferem elétrons para alcançar configurações eletrônicas mais estáveis. Descreve três tipos principais de ligação: iônica, covalente e metálica. Também discute representações de Lewis e propriedades de compostos iônicos e covalentes.