Apoio 1ªsuplementar resolução
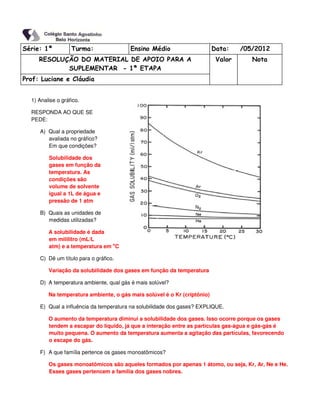
- 1. Série: 1ª Turma: Ensino Médio Data: /05/2012 RESOLUÇÃO DO MATERIAL DE APOIO PARA A Valor Nota SUPLEMENTAR - 1ª ETAPA Prof: Luciane e Cláudia 1) Analise o gráfico. RESPONDA AO QUE SE PEDE: A) Qual a propriedade avaliada no gráfico? Em que condições? Solubilidade dos gases em função da temperatura. As condições são volume de solvente igual a 1L de água e pressão de 1 atm B) Quais as unidades de medidas utilizadas? A solubilidade é dada em mililitro (mL/L atm) e a temperatura em oC C) Dê um título para o gráfico. Variação da solubilidade dos gases em função da temperatura D) A temperatura ambiente, qual gás é mais solúvel? Na temperatura ambiente, o gás mais solúvel é o Kr (criptônio) E) Qual a influência da temperatura na solubilidade dos gases? EXPLIQUE. O aumento da temperatura diminui a solubilidade dos gases. Isso ocorre porque os gases tendem a escapar do líquido, já que a interação entre as partículas gas-água e gás-gás é muito pequena. O aumento da temperatura aumenta a agitação das partículas, favorecendo o escape do gás. F) A que família pertence os gases monoatômicos? Os gases monoatômicos são aqueles formados por apenas 1 átomo, ou seja, Kr, Ar, Ne e He. Esses gases pertencem a família dos gases nobres.
- 2. 2. Considere os seguintes gráficos, para experimentos realizados com amostras inicialmente líquidas: Leia as afirmativas abaixo e julgue se elas são verdadeiras (V) ou falsas (F): a. ( F )Todos os gráficos são de resfriamento. b. ( V )Em todos os gráficos, a temperatura inicial do experimento é 25,0ºC. c. ( F )Em todos os gráficos, a temperatura final do experimento é de 110ºC. d. ( F )No gráfico 3, a partir de 18 minutos do início do experimento, ocorre a evaporação do líquido. e. ( F )A velocidade de aquecimento no gráfico 1 é igual à do gráfico 3. f. ( F )A amostra do gráfico 1 pode ser a mesma do gráfico 3, porém os experimentos foram realizados sob condições diferentes de pressão. g. ( F )A amostra do gráfico 1 pode ser a mesma do gráfico 2, porém os experimentos foram realizados com fontes diferentes de aquecimento. h. ( F )A amostra do gráfico 1 pode ser a mesma do gráfico 3, porém a quantidade de amostra no experimento do gráfico 1 foi maior do que para o gráfico 3. i. ( V )Ao final do experimento do gráfico 4, o béquer no qual foi feito o aquecimento da amostra, ainda continha líquido. j. ( V )Ao final do experimento do gráfico 2, o béquer no qual foi feito o aquecimento da amostra não continha mais a amostra na fase líquida. k. ( V )Após 20 minutos do início do experimento, o béquer no qual foi feito o aquecimento da amostra do gráfico 1 continha uma quantidade de amostra líquida maior do que para o gráfico 2. l. ( V )Pelo gráfico 4, o aquecimento do líquido durou 26 minutos.
- 3. m. ( V )A amostra do gráfico 4 pode ser uma mistura. n. ( V )A amostra do gráfico 2 pode ser uma mistura azeotrópica. o. ( F )Em todos os gráficos, a temperatura de ebulição foi constante. 3ª QUESTÂO Analise o segundo cartaz apresentado pela professora e responda ao que se pede. A) O material é uma substância ou uma mistura? EXPLIQUE utilizando dados do cartaz. O material é constituído por uma mistura de duas substâncias. O sistema representado no cartaz possui moléculas diferentes e cada uma delas representa uma substância. B) Escreva a (s) fórmula (s) da (s) substância (s) que constitui (em) o material. CHCl3 e H2O l C) Classifique o sistema em heterogêneo ou homogêneo. JUSTIFIQUE. O sistema representado é heterogêneo porque as moléculas estão em fases diferentes. O sistema é formado por duas fases líquidas distintas. D) Qual o estado físico do material? EXPLIQUE com base nas diferenças dos modelos de partículas para os estados físicos. A mistura é líquida porque as moléculas encontram-se desorganizadas, mas com poucos espaços entre elas. E) O material é constituído por alguma substância molecular? EXPLIQUE. As substâncias que constituem o sistema são moleculares porque ele é formado de moléculas. Neste sistema, os átomos estão combinados, o que constitui uma molécula.
- 4. F) Represente macroscopicamente, em uma proveta, o sistema representado no cartaz. G) Represente o esboço do gráfico de temperatura em função do tempo, para o aquecimento de uma substância que constitui o material. Sabe-se que esta substância é muito volátil. T Liquido + Vapor Vapor Liquido t 4) Para responder esta questão, observe atentamente os sistemas: I II III IV V VI
- 5. a) Quais sistemas são substâncias puras? __ I e III______________________________ b) Quais sistemas são substâncias simples? ___I____________________________ c) Quais sistemas são substâncias compostas? ___III__________________________ d) Em que sistema temos mistura de 2 componentes? ____II, IV, VI___________________ e) Em que sistema temos mistura de 3 componentes? _____V____________________ CONSIDERE AS INFORMAÇÕES PARA RESPONDER ÀS QUESTÕES 5 a 7 Em um site de perguntas e respostas (http://br.answers.yahoo.com/question/index?qid=20070502044710AAtOkP6), um internauta postou a seguinte pergunta: “Quais as diferenças do sal refinado, sal puro e sal iodado?” Leia a resposta escolhida como a melhor. by ricardo n O sal que usamos no Brasil para consumo humano é praticamente todo vindo da água do mar. Quando a água do mar é colocada nas salinas para que a água evapore, o sal costuma precipitar na forma de cristais grossos (sal grosso), que é uma forma pouco prática para ser usado na culinária. Imagine salgar uma porção de batatas fritas com sal grosso. O sal refinado é este sal grosso passado por moedores e peneiras, de forma que a granulometria final fique bastante fina e homogênea. Este sal contém vários outros sais presentes na água do mar, como sulfatos e carbonatos. O sal puro é o cloreto de sódio puro, com teores maiores que 99,999%. Podemos encontrar no mercado o NaCl PA ou ainda o NaCl USP. O NaCl PA é aquele usado em análises onde seja necessário o uso de um cloreto de sódio com pureza muito alta, sem íons ou cátions que interfiram nas análises. O NaCl USP é aquele que tem um grau de pureza necessário ao uso em produtos farmacêuticos, onde a presença de um mínimo de impurezas nocivas à saúde é rigorosamente proibida. O sal de cozinha é conhecido como sal iodado, pois foi adicionado iodo, na forma de outros dois sais: iodeto de potássio (KI) ou iodato de potássio (KIO3). O iodo serve para prevenir distúrbios causados pela supressão deste mineral de nossa alimentação, os chamados DDIs. DDIs (Distúrbios por Deficiência de Iodo) são problemas de saúde, tais como: o bócio, abortos prematuros, retardos mentais, etc. Para consumo humano, é considerada adequada para um adulto a ingestão de 0,15 mg de iodo por dia. O teor de iodo presente no sal de cozinha é de 20 a 60 mg por quilograma do produto final. Esta é a regulamentação do Ministério da Saúde. Fonte(s): http://www.quiprocura.net/sal.htm http://br.answers.yahoo.com/question/index?qid=20070502044710AAtOkP6
- 6. 5) EXPLIQUE qual a diferença do sal puro e do sal de cozinha usado na culinária. Considere em sua explicação a constituição de cada material, utilizando OBRIGATÓRIAMENTE os termos mistura, substância e elemento químico. A diferença entre sal puro e o sal de cozinha está associada à constituição dos mesmos. Enquanto o sal de cozinha é uma mistura de várias substâncias (cloreto de sódio, iodeto de potássio, iodato de potássio etc.), o sal puro é uma substância formada pela combinação dos elementos químicos sódio e cloro. 6) Sais representam uma classe de substâncias que possuem propriedades comuns. CITE a fórmula de três substâncias que pertencem a esta classe. NaCl , KIO3 , KI l 7) CALCULE a quantidade mínima de sal iodado que devemos consumir para ingerirmos a quantidade adequada de iodo por dia. Atenção: Escreva os dados Demonstre todo o raciocínio com as unidades de medidas apropriadas Escreva a resposta final Dados: 015 mg de iodo/ dia 20 mg a 60 mg de iodo/ kg de sal Raciocínio e Cálculos: 60 mg de iodo _______1000g de sal 0,15 mg __________ X X = 2,5 g OBS: para consumir uma quantidade mínima de sal é preciso consumir o sal com a quantidade máxima de iodo. Resposta: 2,5 g de sal
- 7. CONSIDERE AS INFORMAÇÕES PARA RESPONDER ÀS QUESTÕES 8 e 9 Para estimar o número de pulseiras que pode ser confeccionado com um pote de miçangas, grupos do laboratório do colégio Santo Agostinho escreveram procedimentos diferentes: Grupo A Grupo B Grupo C 1. Confeccionar uma pulseira 1. Confeccionar uma pulseira 1. Confeccionar uma pulseira com 50 miçangas com 50 miçangas. com 50 miçangas. 2. Colocar 50 miçangas em 2. Medir a massa da pulseira 2. Medir a massa de uma uma proveta de 25 mL e feita com 50 miçangas na miçanga na balança medir o volume. balança eletrônica. Anotar. eletrônica. Anotar. 3. Despejar o pote com o 3. Medir a massa de um copo 3. Medir a massa de um copo restante das miçangas em vazio na balança eletrônica. vazio na balança eletrônica. uma proveta de 250 mL. Anotar Anotar 4. Medir o volume. 4. Despejar as miçangas do pote 4. Despejar as miçangas do pote para o copo. para o copo. 5. Medir a massa do copo com 5. Medir a massa do copo com as miçangas na balança as miçangas na balança eletrônica. Anotar eletrônica. Anotar Uma das medidas efetuadas pelo grupo A é mostrada na figura: Os grupos B e C, utilizaram a balança eletrônica que possui as seguintes características: Capacidade mínima = 100 mg Capacidade máxima = 500 g Erro = 1 mg 8) ANOTE a medida efetuada pelo grupo A, ilustrada na figura. Atenção: Utilize a notação correta, ou seja, contendo: • Unidade • algarismos significativos • margem de erro. (5,2 ± 0,1) mL ou (5,4 ± 0,1) mL
- 8. 9) CALCULE o número de pulseiras que poderiam ser feitas com o pote de miçangas, a partir das medidas efetuadas pelo grupo C. Atenção: • Demonstre todo o raciocínio com unidades • Escreva a resposta final Medidas Raciocínio Massa de uma miçanga = 0,050 g 1 pulseira ---- 50 miçangas 1 pulseira ------- 2,5 g Massa do pote vazio = 1 miçanga -------0,050g X ------- 205,005 g 11,550 g Massa do pote com 50 miçangas ----- X = 2,5g X= 82 miçangas = 216,555 g mmiçangas = 216,555g – 11,550g = 205,005 g Resposta final 82 pulseiras 10) Comparando-se os procedimentos escritos pelos grupos, as características dos instrumentos e as medidas anotadas na questão 4. a ) EXPLIQUE uma vantagem do procedimento do grupo B em relação ao grupo A . O erro experimental envolvido no procedimento B é menor que no procedimento A. Isto se deve a diferença dos erros dos instrumentos utilizados, pois o erro da balança (0,001g) é bem menor que o erro da proveta (0,1 mL). Além disto, no procedimento A, existe outro erro que é a existência de espaços entre as miçangas que aumenta o volume. QUESTÕES OBJETIVAS 1) UFRS) Analise os sistemas materiais abaixo, estando ambos em temperatura ambiente. Sistema (I): Mistura de 10g de sal de cozinha, 30g de areia fina, 20 mL de óleo e 100 mL de água. Sistema (II): Mistura de 2,0 L de gás carbônico, 3,0 L de gás nitrogênio e 1,5 L de gás oxigênio. Sobre esses sistemas, é correto afirmar que: a) Ambos são heterogêneos, pois apresentam mais de uma fase. b) Em I, o sistema é bifásico, após forte agitação, e, em II, o sistema é monofásico. c) Em I, o sistema é trifásico, após forte agitação, e, em II, o sistema é monofásico. d) Ambos apresentam uma única fase, formando sistemas homogêneos. e) Em I, o sistema é trifásico, independentemente da ordem de adição dos componentes, e, em II, o sistema é bifásico.
- 9. 2) (FUVEST-SP) Considere a tabela abaixo: Ácido acético e bromo, sob pressão de 1 atm, estão em recipientes imersos em banhos, como mostrado: Nas condições indicadas acima, qual é o estado físico preponderante de cada uma dessas substâncias? Bromo Líquido Gasoso Sólido Gasoso líquido e 3) Assinale a alternativa correta. a) Sempre que uma substância pura recebe calor sua temperatura aumenta. b) A liquefação é uma transformação endotérmica. c) A temperatura de mudança de estado de uma substância pura não depende da pressão. d) A fusão de uma substância pura, sob pressão constante, é uma transformação endotérmica. e) Para qualquer pressão a temperatura de fusão do gelo é 0°C. 4) Considere o ponto de ebulição e o de fusão de algumas substâncias, conforme a tabela a seguir: Assinale a alternativa INCORRETA. a) Podemos afirmar que seria possível encontrar oxigênio e dióxido de carbono no estado líquido, na temperatura de 73 K. b) O leite e o vinagre são misturas de substâncias, e, por essa razão, possuem pontos de fusão e de ebulição variáveis. c) O estado físico do benzeno, álcool etílico, éter etílico e água na temperatura de 110ºC é gasoso. d) Na temperatura de 230K, mercúrio, sódio metálico, cloreto de sódio, água e benzeno se encontram no estado sólido. e) Os valores dos pontos de ebulição e de fusão das substâncias não variam com a quantidade destas.
- 10. 5) Observe os fatos abaixo: I) Uma pedra de naftalina deixada no armário. II) Uma vasilha com água deixada no freezer. III) Uma vasilha com água deixada no sol. IV) O derretimento de um pedaço de chumbo quando aquecido. Nesses fatos estão relacionados corretamente os seguintes fenômenos: a) I. Sublimação; II. Solidificação; III. Evaporação; IV. Fusão. b) I. Sublimação; II. Sublimação; III. Evaporação; IV. Solidificação. c) I. Fusão; II. Sublimação; III. Evaporação; IV. Solidificação. d) I. Evaporação; II. Solidificação; III. Fusão; IV. Sublimação. e) I. Evaporação; II. Sublimação; III. Fusão; IV. Solidificação. 6) Acerca das mudanças de estado de agregação, considere as afirmações a seguir: I. Solidificação é a passagem de um material do estado líquido para o estado sólido. O processo ocorre quando o material é resfriado, caracterizando um fenômeno endotérmico. II. Considere a mudança de estado: cânfora (sólida) → cânfora (gasosa). Essa mudança de estado é um fenômeno endotérmico. III. A mudança do estado gasoso para o estado líquido ocorre com liberação de calor. Está correto o que afirma em: a) II e III, apenas. b) III, apenas. c) I, II e III. d) I, apenas. e) II, apenas. 7) Considere quantidades iguais de água nos três estados físicos: sólido; líquido e gasoso, relacionados no esquema a seguir: Marque a alternativa CORRETA. a) O processo (I) é denominado condensação. b) O processo (II) envolve absorção de energia. c) O processo (III) é acompanhado de uma diminuição de densidade. d) O processo (IV) é denominado vaporização e) O vapor d’água está em estado mais energético do que a água líquida e sólida. 8) Durante a mudança de estado físico de uma substância pura a: a) temperatura varia uniformemente. b) temperatura será constante se variar à pressão. c) temperatura depende da fonte de calor. d) temperatura se mantém constante, à pressão constante. e) temperatura varia independente de outros fatores.
- 11. 9) Uma amostra de uma espécie química foi analisada em um laboratório e, como resultado, obteve-se o seguinte gráfico: Todas as afirmativas a respeito do gráfico estão corretas, exceto: a) O gráfico representa a mudança de fase de uma espécie química pura. b) A temperatura de fusão da espécie química é menor que a da água pura. c) O tempo gasto para fundir a espécie química é o mesmo gasto na ebulição. d) Abaixo de 0 ºC, a espécie química está totalmente na fase líquida. e) No intervalo de tempo entre 15 e 20 segundos, a espécie química está na fase líquida. 10) Tintura de iodo é uma solução alcoólica de I2 e KI. Deixou-se um frasco dessa solução aberto e depois de certo tempo observou-se que restavam no fundo grãos de cores violeta e branca. Pode-se concluir, a partir desses dados, que: a) a mistura original era heterogênea b) ocorreu cristalização da solução c) ocorreu sublimação dos componentes d) ocorreu vaporização do soluto e) ocorreu vaporização do solvente, restando cristais de iodo e de iodeto de potássio. Fonte: www.agamenonquimica.com 11) O álcool etílico é um material muito utilizado no dia a dia. È muito volátil, incolor e é menos denso do que a água. Considerando-se as informações do produto Álcool 70% e outros conhecimentos é CORRETO afirmar que o Álcool 70% A) é conhecido como etanol e tem fórmula C2H6O. B) tem densidade maior que do álcool 92,5 %. C) tem um aspecto heterogêneo. D) é um produto quimicamente puro. 12) (UFPB- 2007) Numa proveta graduada contendo 500mL de água (d=1g/cm3), colocou-se uma prótese metálica de massa igual a 112,5g. Observou-se que a prótese imergiu e que o nível da água na proveta passou a ser 525mL. De posse desses dados e considerando a tabela abaixo, é correto afirmar que a prótese em questão é feita de: a) platina. b) titânio c) alumínio. d) ouro e) prata.