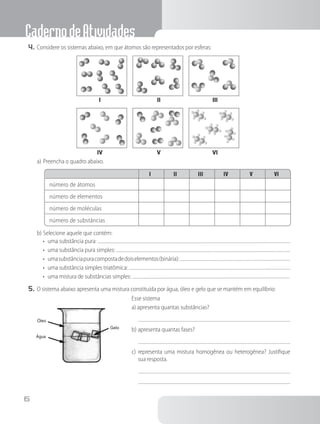
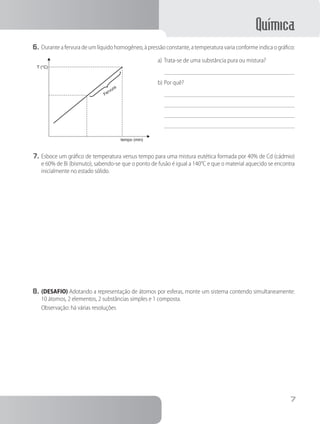
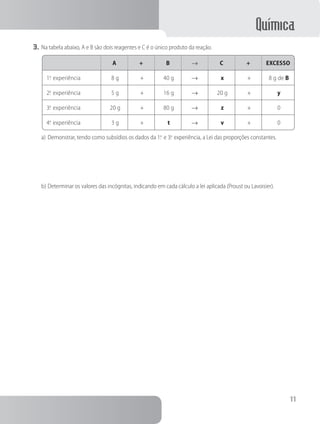
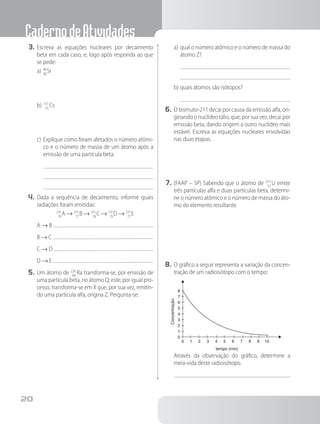
1. O documento apresenta um caderno de atividades sobre química para o ensino médio, com tópicos como a estrutura da matéria, reações químicas, tabela periódica e estudos de gases.
2. Inclui questões e exercícios sobre esses assuntos, além de informações sobre os autores e editora.
3. O objetivo é auxiliar os estudantes na aprendizagem dos principais conceitos da química no ensino médio.























![CadernodeAtividades
28
6. Relativamente aos elementos M e Q, de números atômicos 34 e 19, respectivamente, pede-se:
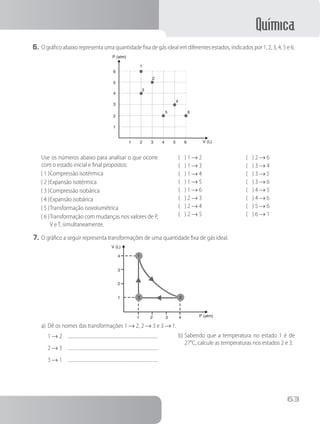
a) a distribuição eletrônica para os elementos;
b) a fórmula do composto que os dois elementos formariam por reação.
7. Dê a fórmula de Lewis correspondente de cada par de elementos químicos, conforme modelo abaixo:
Exemplo: Ca e Cℓ
Fórmula: Ca2+
[ Cℓ ]–
2
a) Aℓ e F
b) Aℓ e S
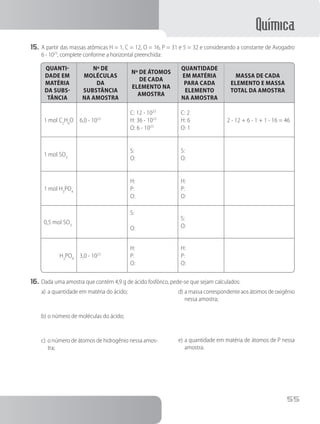
c) K e I
d) Mg e H
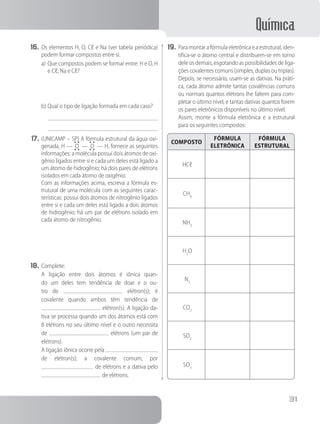
e) Na e H
f) Li e O
8. Sobre os elementos genéricos X eY, sabe-se que o primeiro é da família dos alcalinos-terrosos e que o segundo
é do grupo 7 A. Determine a fórmula de Lewis referente ao composto formado por esses dois elementos.
9. Os subníveis mais energéticos, no estado fundamental, de dois elementos químicos X eY são, respectivamente,
4p5
e 3s1
.
a) Qual a fórmula provável de um composto formado por esses dois elementos?
b) Que tipo de ligação química deve predominar nesse composto?](https://image.slidesharecdn.com/exerciciosdequimica-220411013911/85/EXERCICIOS-DE-QUIMICA-pdf-28-320.jpg)