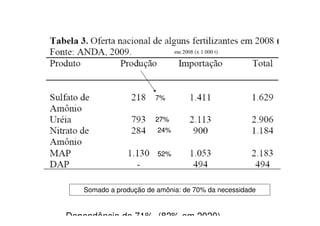
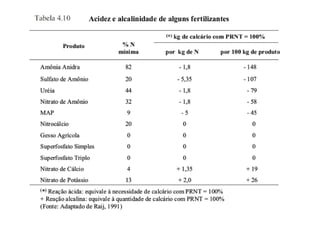
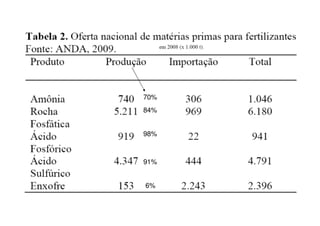
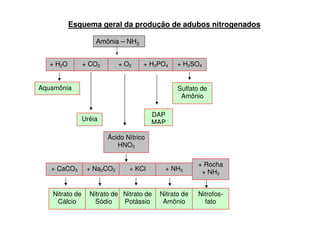
O documento descreve os principais fertilizantes nitrogenados e seu processo de produção. A síntese de amônia é responsável por 99% dos fertilizantes nitrogenados e envolve a reação do gás natural com água e posterior injeção de ar quente sob pressão para formar amônia. Os principais fertilizantes nitrogenados produzidos a partir da amônia são ureia, nitrato de amônio e sulfato de amônio.


![Fertilizantes Nitrogenados
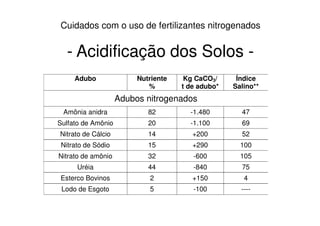
Amônia anidra - NH3 - (82 % N) - tem que ser armazenada sob pressão na forma líquida. Sua aplicação no
campo exige o uso de tanque sob alta pressão e é injetada diretamente dentro do solo. As chances de perda
do gás NH3 são elevadas. Este composto é tóxico e retarda a nitrificação e tem ação acidificante no solo. Muito
comum em paízes de agricultura tecnificada como nos EUA, onde representa cerca de 40 % de todo o N
utilizado. Seu uso é pouco difundido no Brasil, embora na região canavieira de São Paulo algumas usinas já
façam uso dessa fonte de N.
Uréia - CO (NH2)2 - (45 % N) - é produzida pela reação do NH3 com CO2 sob pressão e temperatura elevadas.
Para seu uso eficiente, é necessário o conhecimento de suas propriedades e de seu comportamento no solo.
Principal fertilizante sólido utilizado no mundo
Nitrato de amônio - NH4NO3 - (33 % N) - é produzido pela reação do ácido nítrico com amônia. Tem metade
do seu N na forma amoniacal e metade na forma nítrica, ou seja, formas prontamente disponíveis para as
plantas. É o fertilizante mais empregado em diversos países do norte de Europa e o segundo no Brasil. Como
desvantagem para seu uso tem-se o difícil manuseio e armazenagem, devido sua elevada higroscopicidade; ao
tomar contato com a umidade do ar ou qualquer fonte de carbono oxidável, forma mistura explosiva.
Sulfato de amônio - (NH ) SO - (20 % N) - pode ser obtido pela reação do NH com H SO ou pode-se reagirSulfato de amônio - (NH4)2SO4 - (20 % N) - pode ser obtido pela reação do NH3 com H2SO4 ou pode-se reagir
NH3 com CO2 para formar (NH4)2CO3, que é posteriormente combinado com gêsso, obtendo-se CaCO3 +
(NH4)2SO4. O sulfato de amônio é pouco higroscópico e também boa fonte de enxofre, com 24 % do elemento.
Sua reação no solo é ácida, sendo desaconselhável para solos que sofreram calagem, além de apresentar
maior custo por kg de N, devido ao baixo teor do elemento.
Nitrato de Cálcio – Ca(NO3)2 (15 a 16 % N e 19 % Ca) – é produzido pela reação do ácido nítrico com
carbonato de cálcio. Produzido principalmente na Europa.
Monoamônio fosfato – MAP - (NH4H2PO4) (11-48-0) e o Diamônio fosfato – DAP – [(NH4)2HPO4] (18-48-0)
- são considerados mais como fontes de P do que de N, mas sob certas condições podem ser utilizados com
vantagem para suprimento deste último elemento.
Nitrato de sódio - NaNO3 - (16 % N) - o produto químico é obtido pela reação do ácido nítrico com o cloreto de
sódio ou carbonato de sódio. Importante: existe uma fonte natural deste fertilizante no Chile e, por isso, é
também conhecido como salitre do Chile.
Nitrato de potássio - KNO3 - (13 % N e 44 % K2O) - pode ser obtido pela reação de cloreto de potássio com
ácido nítrico ou nitrato de sódio.](https://image.slidesharecdn.com/tiposfertilizantesnpk-130520201101-phpapp02/85/Tipos-fertilizantes-npk-6-320.jpg)