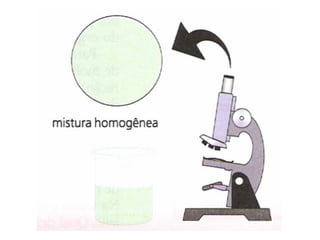
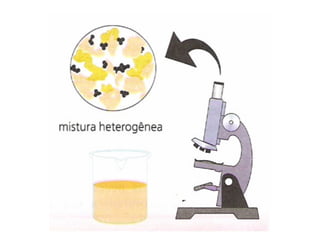
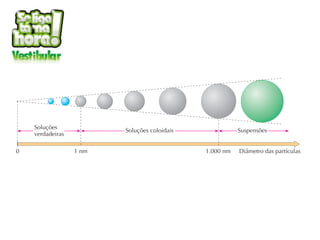
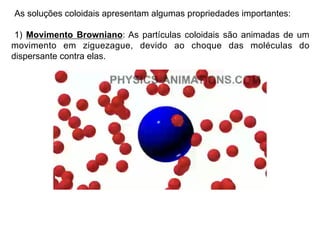
O documento discute soluções, soluções coloidais e suspensões. Ele define soluções como misturas homogêneas formadas por um solvente e um ou mais solutos, com as partículas do soluto menores que 10 angstroms. Soluções coloidais têm partículas entre 10-1000 angstroms, apenas visíveis em microscópio, enquanto suspensões têm partículas acima de 1000 angstroms, visíveis a olho nu.