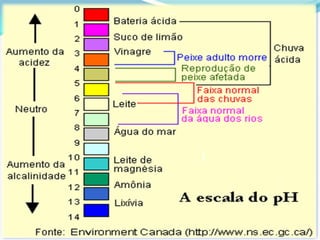
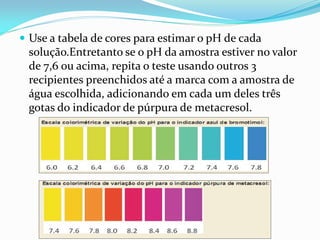
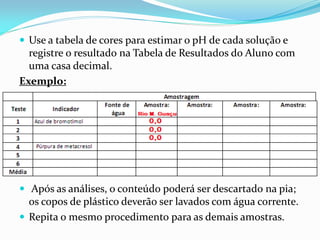
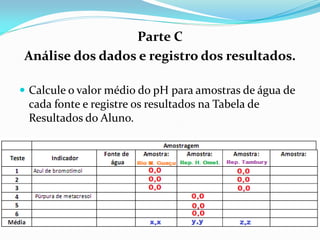
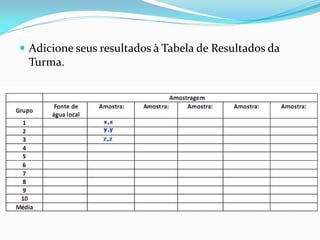
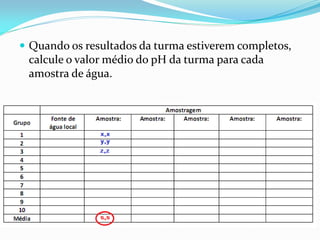
O documento descreve um experimento sobre a medição do pH da água de fontes em Araras-SP como parte do Experimento Global da Água coordenado pela IUPAC e UNESCO. O objetivo é determinar o pH e analisar os resultados para avaliar a qualidade da água e os impactos ambientais.