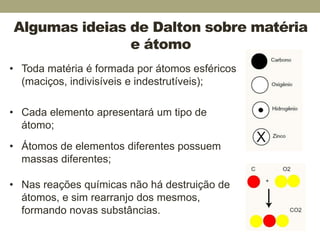
Este documento descreve o modelo atômico de Dalton de 1803, no qual os átomos eram considerados esféricos, maciços, indivisíveis e indestrutíveis. Apesar de limitações, o modelo de Dalton explicava comportamentos da matéria e estimulou o pensamento sobre a existência de átomos. Experimentos posteriores mostraram que os átomos podiam ser divisíveis e penetráveis, levando ao desenvolvimento de modelos atômicos mais precisos.