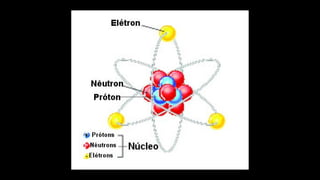
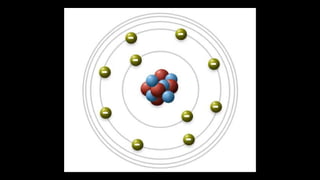
O documento descreve a evolução dos modelos atômicos ao longo do tempo, começando pelas ideias filosóficas de Leucipo e Demócrito na Grécia Antiga, passando pelas contribuições de Boyle, Dalton, Thomson e Rutherford, e chegando ao modelo atômico de Bohr, que determinou que os elétrons ocupam camadas eletrônicas de energia definida ao redor do núcleo.