Este documento apresenta instruções para vários experimentos químicos relacionados a materiais, reações térmicas, sistemas gasosos e produtos naturais. Inclui procedimentos para a síntese de polímeros como o poliestireno, PVC, borracha natural e nylon, bem como experimentos envolvendo gelificação, corrosão e extrações de compostos orgânicos.













![Química Espectacular 2009
A.8 – Corrosão
Material:
5 Placas de Petri Espátula Pinça
Pipetas de Pasteur Vareta Gobelé de 500 cm3
Reagentes:
Fita de magnésio Solução alcoólica de fenolftaleína
Fio de cobre Solução 0,5 mol/dm3 K3[Fe(CN)6]
Fio de zinco Gelatina em pó ou folhas de gelatina incolor (4 a 6
Folha de alumínio folhas de gelatina equivalem a 1 pacote)
Pregos
Esquema de montagem:
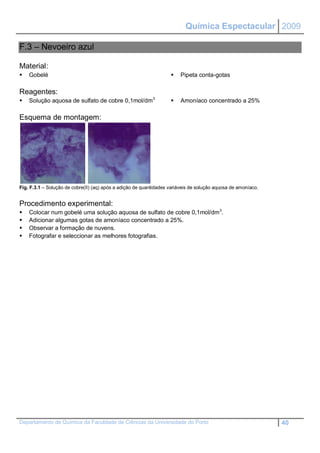
Fig. A.8.1 – Prego em gelatina.
Procedimento experimental:
Prepare 250 cm3 de uma solução de gelatina, dissolvendo um pacote de gelatina incolor em água
morna.
Adicione 4 gotas de solução de fenolftaleína e 2 gotas da solução aquosa de hexacianoferrato(III) de
potássio à solução de gelatina.
Distribua a solução de gelatina por 5 caixas de Petri.
Coloque os pregos do mesmo tamanho enrolados nos metais (magnésio, zinco, cobre e alumínio) nas
primeiras caixas de Petri.
Coloque um prego do mesmo tamanho sem qualquer tipo de protecção na 5ª caixa de Petri.
Observe e registe as observações ao longo do tempo.
Departamento de Química da Faculdade de Ciências da Universidade do Porto 13](https://image.slidesharecdn.com/manualqumicaespectacular-090723180125-phpapp02/85/Manual-Quimica-Espectacular-14-320.jpg)