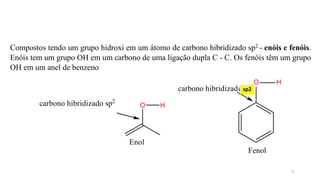
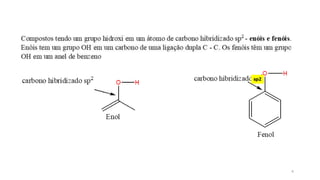
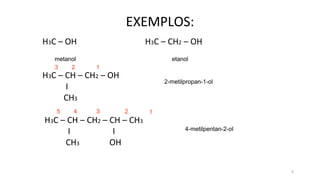
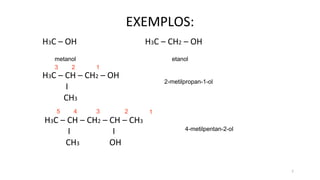
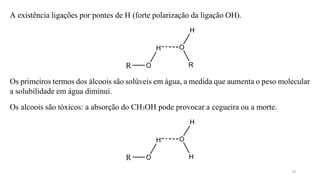
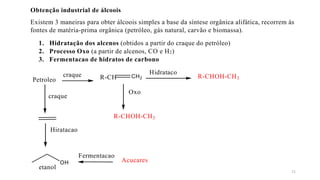
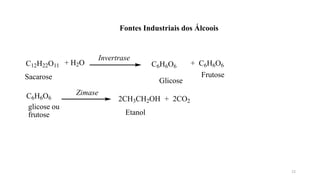
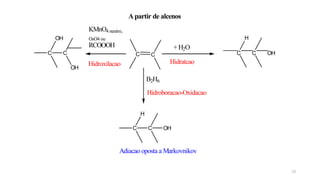
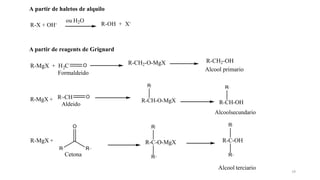
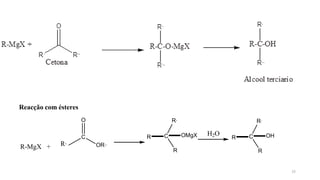
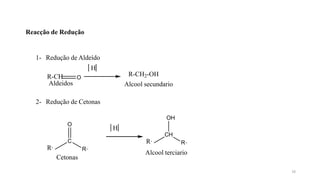
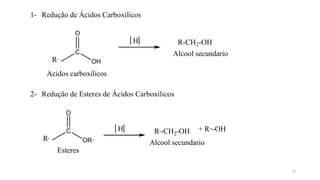
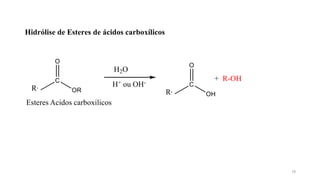
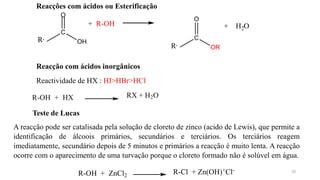
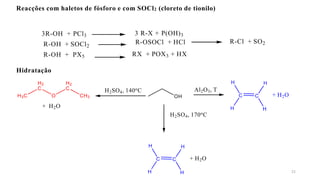
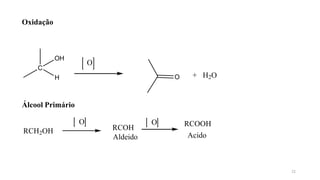
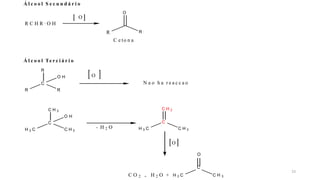
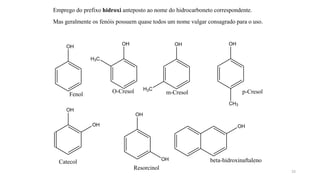
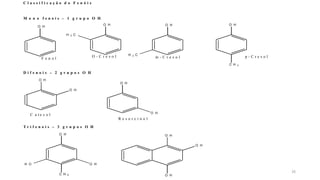
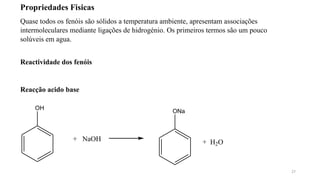
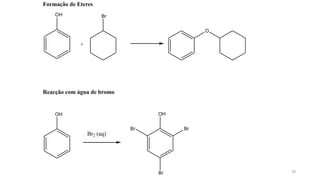
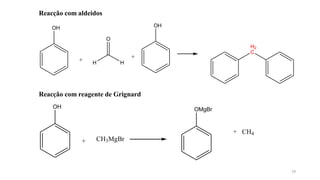
O documento descreve as propriedades e classificação dos álcoois e fenóis. Álcoois contêm o grupo funcional hidroxi ligado a um carbono hibridizado sp3 e são classificados como primário, secundário ou terciário. Fenóis contêm o grupo hidroxi ligado a um anel de benzeno. Ambos os compostos apresentam reatividade devido à polarização da ligação carbono-oxigênio.