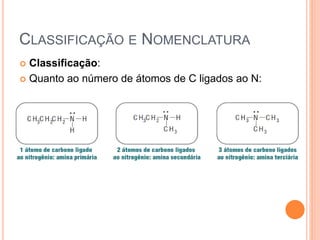
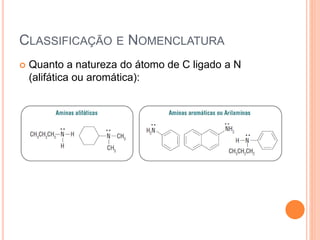
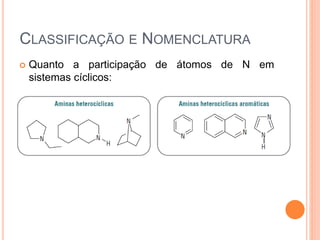
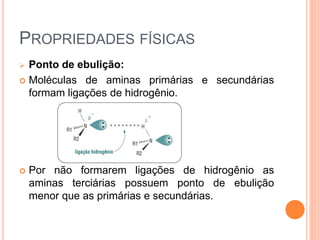
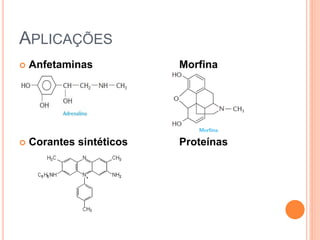
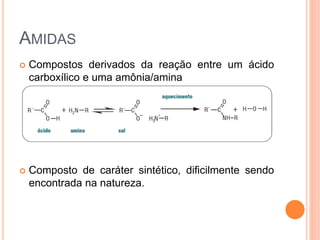
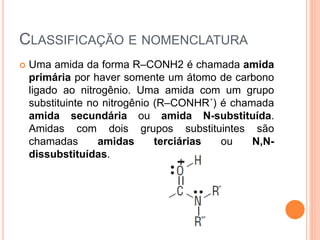
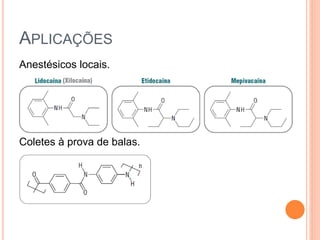
Aminas são compostos derivados da amônia que incluem substâncias biológicas importantes. São classificadas de acordo com o número de átomos de carbono ligados ao nitrogênio e sua natureza. Amidas são compostos formados pela reação entre um ácido carboxílico e uma amina/amônia, sendo usadas em anestésicos e coletes à prova de balas.