Este documento descreve um experimento de complexometria para determinar os teores de cobre e zinco em uma amostra de latão. Foram realizadas duas titulações: na primeira, determinaram-se as concentrações de Cu2+ e Zn2+ juntos, e na segunda, apenas Zn2+ após adição de tiossulfato de sódio para mascarar o Cu2+. Isso permitiu calcular separadamente cada concentração e a porcentagem de cada metal na amostra, que foram de 41,07% de Zn e 65,72% de Cu.
![QA217 – Química analítica fundamental II
Data: 20/10/2017
1
Fernanda Borges de Souza RA:196888
Experimento 08 – Complexometria: Determinação de Cu2+ e de
Zn2+ em Latão
1. Informações introdutórias
Volume da pipeta: 14,8456 ± 0,01 mL
2. Resultados
2.1. Preparo da solução de amostra de latão
A massa de latão necessária é: 0,15 a 0,16 g
Massa pesada: 0,1576 g
2.2. Solução de EDTA
Massa de EDTA pesada: 7,4442 g
Concentração da solução: 0,02 mol.L-1
(Solução preparada no experimento anterior, 06/10/2017)
2.3. Titulação da amostra de latão
- Reações envolvidas:
3Zn (s) + 8HNO3 → 3Zn2+ + 6NO3
- + 2NO (g) + 4H2O
Zn2+ + 4H2O → [Zn (H2O)4]2+
3Cu (s) + 8HNO3 → 3Cu2+ + 6NO3
- + 2NO (g) + 4H2O
Cu2+ + 4H2O → [Cu (H2O)4]2+
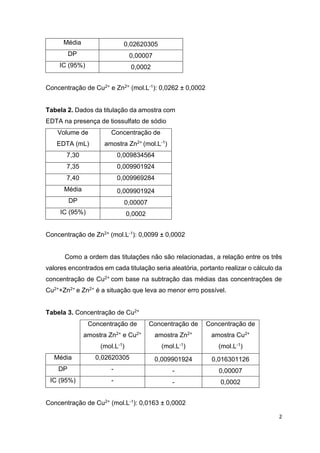
Tabela 1. Dados da titulação da amostra com
EDTA sem a presença de tiossulfato de sódio
Volume de
EDTA (mL)
Concentração de amostra
Zn2+ e Cu2+ (mol.L-1)
19,40 0,02613569
19,50 0,02627041
19,45 0,02620305
Complexo Incolor
Complexo Azul](https://image.slidesharecdn.com/relatrioexperimento08-complexometriadeterminaodecobreezincoemlato-180127122753/85/Relatorio-complexometria-determinacao-de-cobre-e-zinco-em-latao-1-320.jpg)