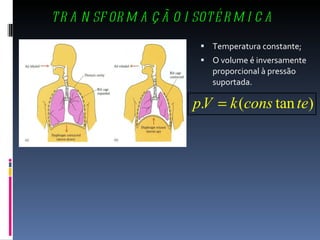
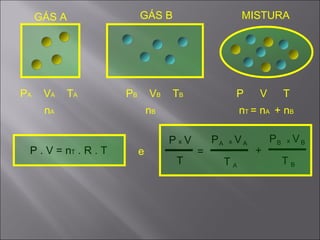
O documento discute conceitos fundamentais sobre gases, incluindo:
1) A pressão de um gás resulta da colisão de suas moléculas com as paredes do recipiente que o contém.
2) O volume de um gás depende do recipiente que o contém, mas os próprios gases não possuem volume próprio.
3) São apresentadas leis que relacionam volume, pressão e temperatura em transformações isotérmicas, isobáricas e isocóricas.
4) A equação de Clapeyron relaciona