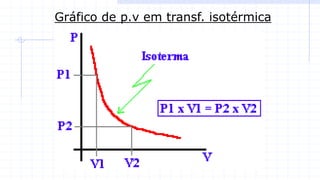
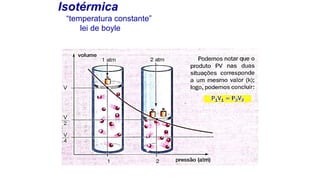
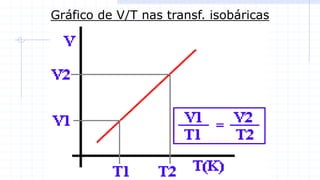
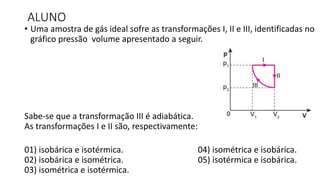
O documento descreve o modelo teórico de gás perfeito, que aproxima o comportamento dos gases reais. Um gás perfeito possui baixa densidade, está acima da temperatura crítica e tem moléculas que se movimentam desordenadamente e colidem elasticamente. O documento também apresenta a lei geral dos gases e como pressão, temperatura e volume se relacionam em transformações isot