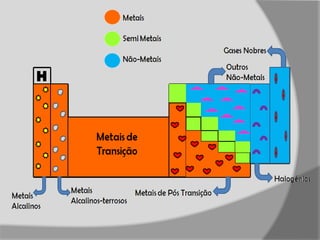
Este documento descreve as propriedades dos metais e não-metais. Resume que metais são normalmente sólidos, densos, maleáveis e bons condutores, enquanto não-metais podem estar em diferentes estados físicos e são geralmente quebradiços e maus condutores. Também discute a reatividade química dos metais e não-metais, notando que a maioria dos metais são reativos ao perder elétrons, enquanto a reatividade dos não-metais varia.