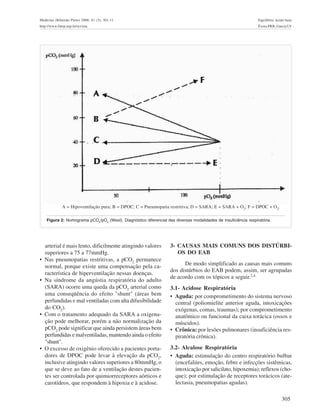
O documento discute os conceitos fundamentais do equilíbrio ácido-base, incluindo os tampões, a equação de Henderson-Hasselbalch e os mecanismos de excreção de H+. Aborda também o diagnóstico de distúrbios do equilíbrio ácido-base através da análise gasométrica sanguínea e as interações com o equilíbrio hidroeletrolítico.