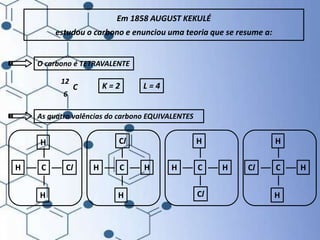
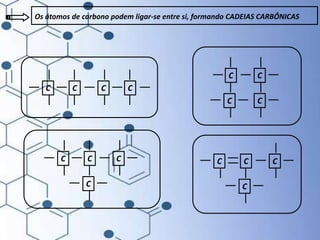
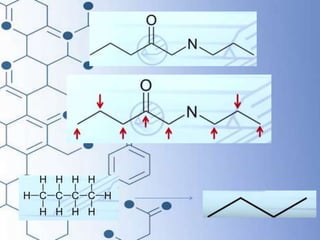
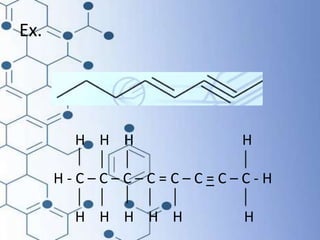
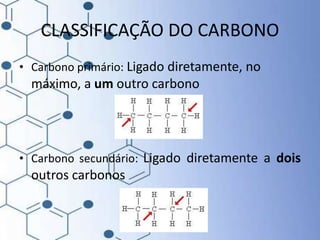
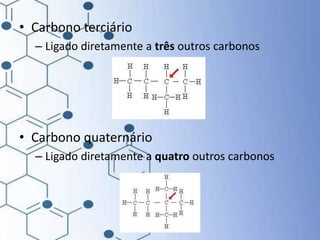
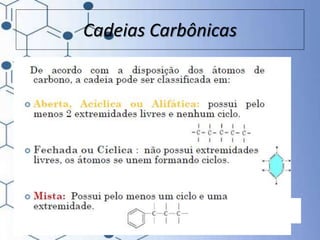
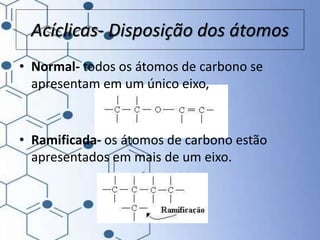
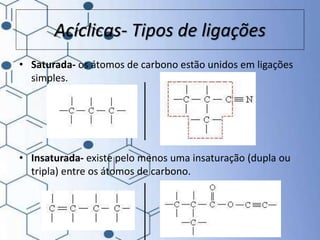
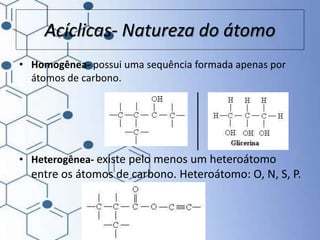
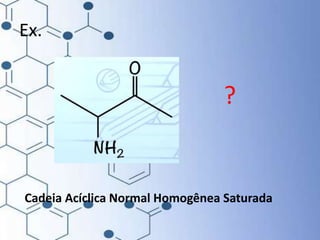
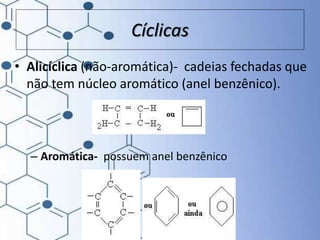
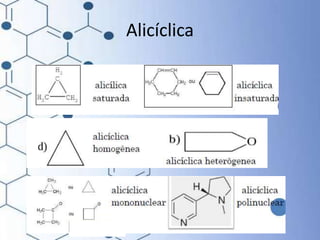
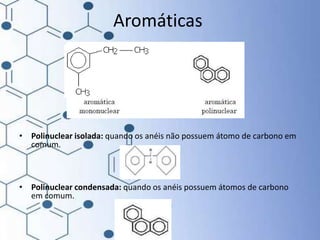
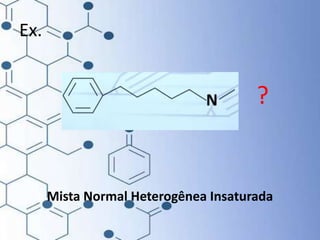
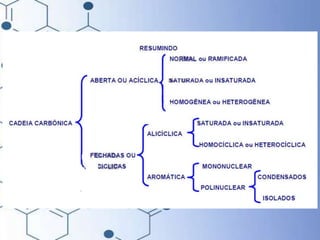
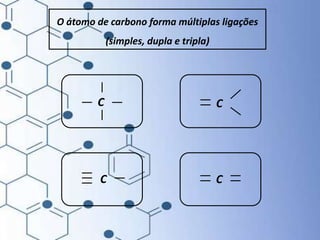
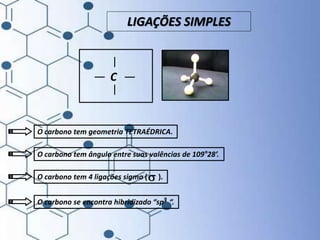
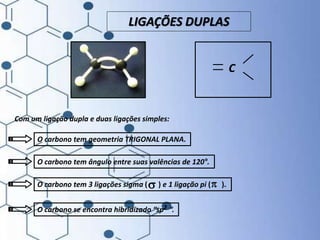
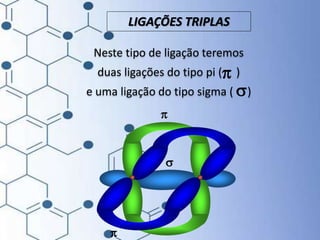
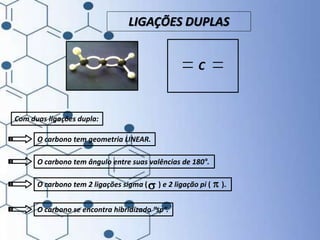
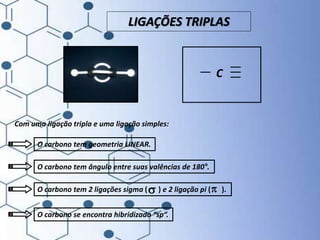
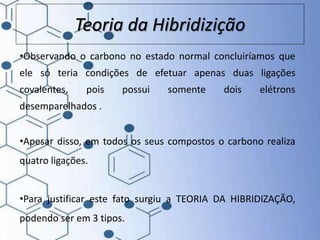
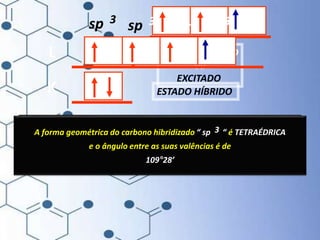
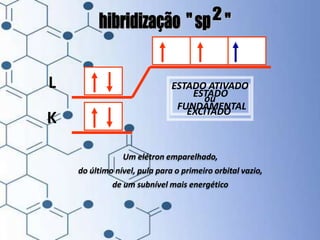
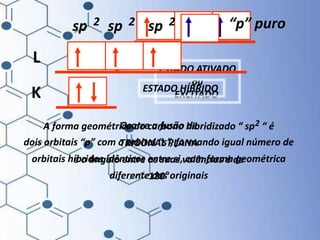
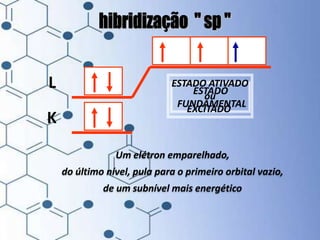
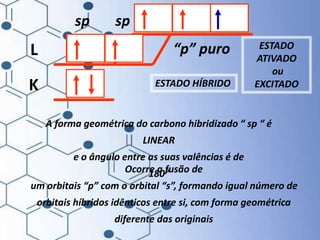
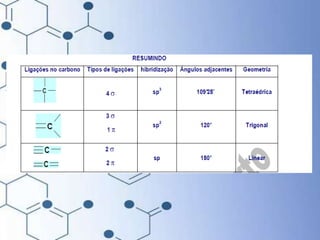
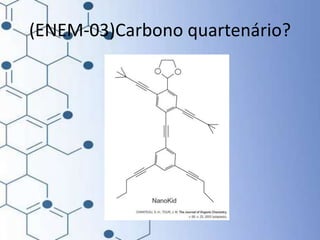
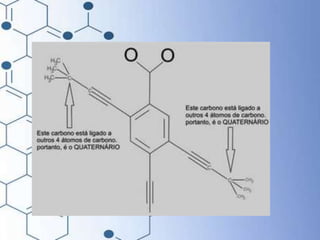
O documento trata da química orgânica, destacando a definição de compostos orgânicos como aqueles que contêm carbono e a teoria da tetravalência do carbono. Aborda a classificação dos carbonos, cadeias carbônicas, tipos de ligações e a teoria da hibridização, que explica como o carbono forma quatro ligações covalentes em seus compostos. Inclui informações sobre a geometria dos carbonos em diferentes estados de hibridização.