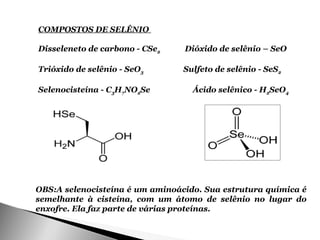
O documento resume as propriedades químicas dos elementos calcogênios oxigênio, enxofre, selênio e telúrio. Detalha suas características, como ponto de fusão e ebulição, eletronegatividade e primeiras energias de ionização. Também descreve onde são encontrados na natureza e seus principais compostos e usos.