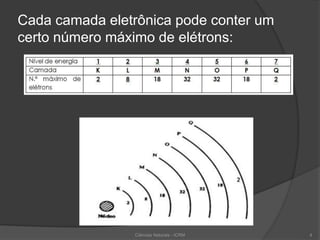
1) Os elétrons orbitam em torno do núcleo ocupando regiões chamadas níveis de energia ou camadas eletrônicas, numeradas de 1 a 7. 2) Os elétrons podem mudar de camada, liberando ou absorvendo energia. 3) A tabela periódica organiza os elementos químicos em linhas e colunas de acordo com suas propriedades periódicas.