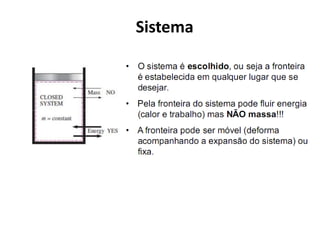
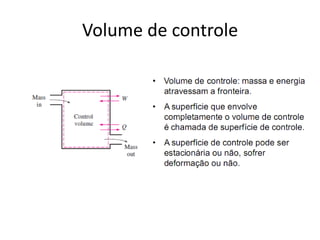
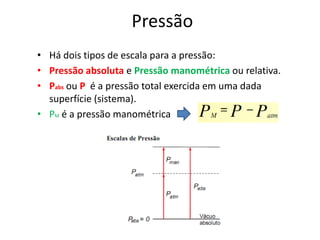
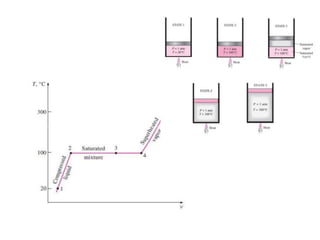
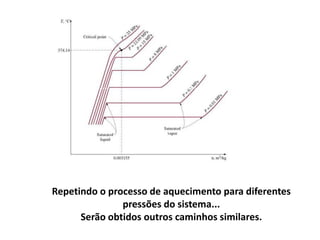
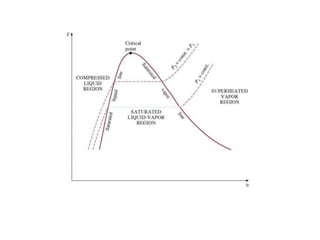
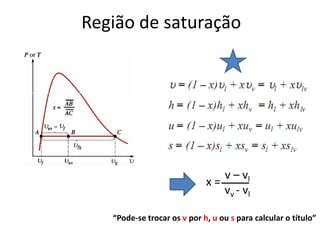
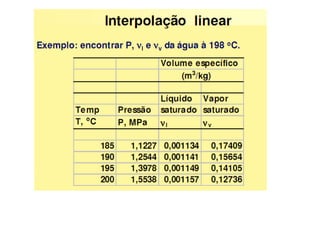
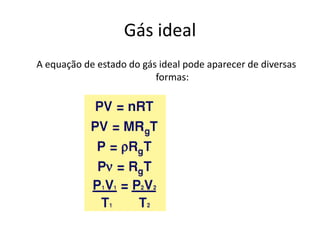
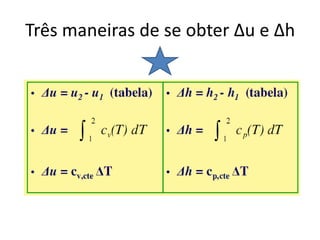
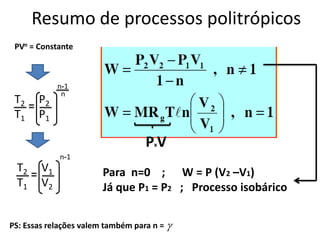
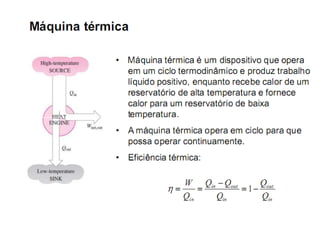
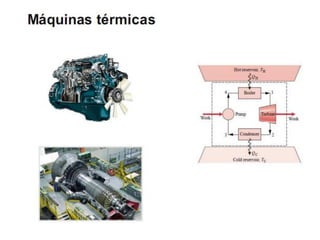
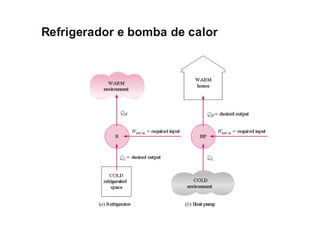
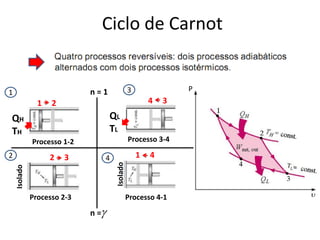
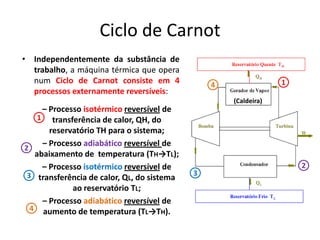
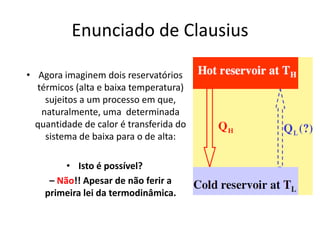
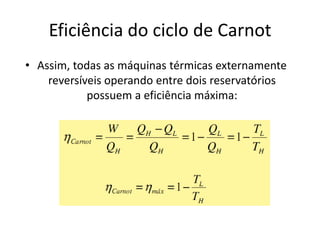
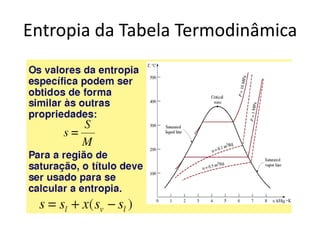
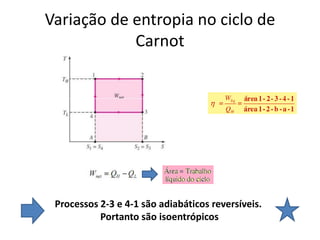
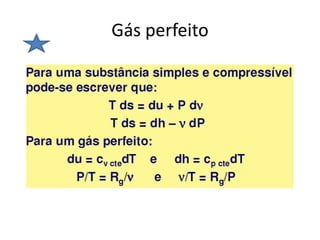
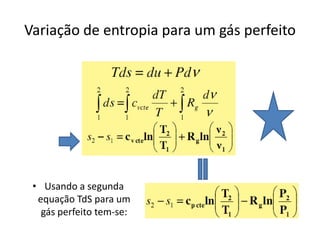
O documento discute vários tópicos da termodinâmica, incluindo: (1) tipos de pressão e propriedades de saturação; (2) ciclo de Carnot e sua eficiência máxima; (3) enunciados da segunda lei da termodinâmica sobre a impossibilidade de transferência total de calor de um corpo frio para um quente.