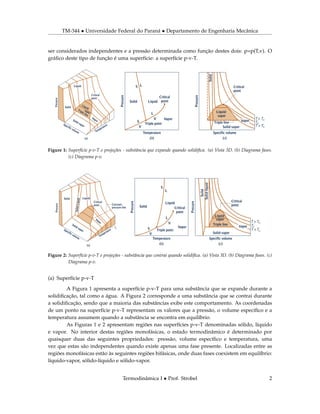
(1) O documento discute propriedades termodinâmicas de sistemas simples compressíveis e substâncias puras, incluindo suas relações pressão-volume-temperatura e mudanças de fase. (2) Apresenta diagramas como p-v-T, fases, p-v e T-v para ilustrar essas propriedades e relações. (3) Explica como obter propriedades como volume específico e entalpia por meio de tabelas e interpolação linear.




![TM-344 • Universidade Federal do Paraná • Departamento de Engenharia Mecânica
Figure 5: Ilustração da interpolação linear.
Para determinar o volume específico v correspondente a 215◦C, podemos pensar na in-
clinação de uma linha reta que une os estados adjacentes da tabela, como segue:
incl. =
(0, 2275 − 0, 2060)m3
kg
(240 − 200)◦C
=
(v − 0, 2060)m3
kg
(215 − 200)◦C
v = 0, 2141
m3
kg
(a) Volume Especifico
O volume específico de uma mistura bifásica líquido-vapor pode ser determinado pela
utilização das tabelas de saturação e pela definição de título dada pela equação descrita a seguir.
O volume total da mistura é a soma dos volumes das fases líquidas e de vapor.
V = Vliq + Vvap
Dividindo pela massa total da mistura, m, o volume específico médio para a mistura é:
v =
V
m
=
Vliq
m
+
Vvap
m
Uma vez que a fase líquida é composta por líquido saturado e que a fase vapor é com-
posta por vapor saturado, Vliq = mliq.vliq e Vvap = mvap.vvap, então:
v =
mliq
m
.vliq +
mvap
m
.vvap
Utilizando a definição de título, onde x =
mvapor
m , e notando que mliq = m − mvap, tem-se:
v = (1 − x).vliq + x.vvap
v = vls + x.(vvs − vls)[
m3
kg
]
Termodinâmica I • Prof. Strobel 6](https://image.slidesharecdn.com/aula02-propriedadestermodinu00c2micas-150305084557-conversion-gate01/85/Aula-02-propriedades-termodi-nu00-c2micas-6-320.jpg)
![TM-344 • Universidade Federal do Paraná • Departamento de Engenharia Mecânica
(b) Energia interna específica, entalpia e entropia
Em diversas análises termodinâmicas, a soma da energia interna com o produto da
pressão pelo volume se faz presente. Uma vez que a soma U + pV aparece tão freqüentemente
em discussões futuras, é conveniente dar a esta combinação um nome, entalpia, e um símbolo
específico, H. Por definição,
H = U + pV[kJ]
A entalpia pode ser expressa em base mássica, ficando na forma:
h = u + pv[
kJ
kg
]
As unidades de entalpia são as mesmas utilizadas para a energia interna. São obtidos,
através das tabelas de propriedades, dados para a energia interna específica u e de entalpia
h, da mesma forma que o volume específico. A energia interna específica para uma mistura
bifásica líquido-vapor é calculada para um dado título da mesma forma que o volume específico
é calculado:
u = uls + x.(uvs − uls)[
kJ
kg
]
De forma similar, a entalpia específica de uma mistura bifásica líquido-vapor é dada em
termos do título por:
h = hls + x.(hvs − hls)[
kJ
kg
]
A entropia, por sua vez, é uma propriedade que mede o grau de desordem de um sistema,
e é comumente utilizado em análises termodinâmicas de segunda lei. De forma similar, a entropia
específica de uma mistura bifásica líquido-vapor é dada em termos do título por:
s = sls + x.(svs − sls)[
kJ
kgK
]
5 EXERCÍCIOS PROPOSTOS
1. Utilizando as tabelas para a água, determine os dados de propriedades especificadas nos
estados indicados. Para cada caso, localize o estado manualmente a partir dos esboços de
diagramas P-v e T-v.
(a) A P=3 bar, T= 240 ◦C, avalie v em m3/kg e u em kJ/kg; [superaquecido, v=0,7804
m3/kg e u=2713 kJ/kg]
(b) A P=3 bar, v=0,5 m3/kg, avalie T em ◦C e u em kJ/kg; [liquido-vapor, T=133,5 ◦C e
u=2195 kJ/kg]
(c) A T=400 ◦C, P= 10 bar, avalie v em m3/kg e h em kJ/kg; [superaquecido, v=0,3066
m3/kg e h=3264 kJ/kg]
Termodinâmica I • Prof. Strobel 7](https://image.slidesharecdn.com/aula02-propriedadestermodinu00c2micas-150305084557-conversion-gate01/85/Aula-02-propriedades-termodi-nu00-c2micas-7-320.jpg)
![TM-344 • Universidade Federal do Paraná • Departamento de Engenharia Mecânica
(d) A T=320 ◦C, v=0,03 m3/kg, avalie P em MPa e u em kJ/kg; [superaquecido, P=7,354
MPa e u=2682 kJ/kg]
(e) A P=28 MPa, T=520 ◦C, avalie v em m3/kg e h em kJ/kg; [crítico, v=0,01019 m3/kg e
h=3194 kJ/kg]
(f) A T=100 ◦C, x=60%, avalie P em bar e v em m3/kg; [liquido-vapor, P=1,013bar e
v=1,005 m3/kg]
(g) A T=10 ◦C, v=100 m3/kg, avalie P em kPa e h em kJ/kg; [liquido-vapor, P=1,228 kPa
e h=2372 kJ/kg]
(h) A P=4 MPa, T=160 ◦C, avalie v em m3/kg e u em kJ/kg; [liq. subresfriado, v=0,001099
m3/kg e u=673,2 kJ/kg]
2. Determine os valores das propriedades especificadas para cada condição a seguir.
(a) Para o R134a a T=60 ◦C e v=0,072 m3/kg, determine P (kPa) e h (kJ/kg). [P=363 kPa e
h=302,1 kJ/kg]
(b) Para a amônia a P=8bar e v=0,005 m3/kg, determine T (◦C) e u (kJ/kg). [T=17,84 ◦C e
u=285,4 kJ/kg]
(c) Para R22 a T=-10 ◦C e u = 200 kJ/kg, determine P (bar) e v (m3/kg). [P=3,8485 bar e
v=0,0574 m3/kg]
Termodinâmica I • Prof. Strobel 8](https://image.slidesharecdn.com/aula02-propriedadestermodinu00c2micas-150305084557-conversion-gate01/85/Aula-02-propriedades-termodi-nu00-c2micas-8-320.jpg)