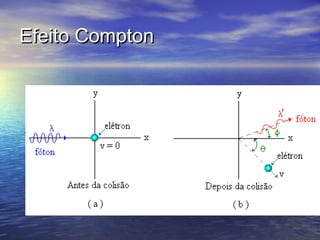
O documento descreve a teoria quântica da luz proposta por Planck e Einstein. Planck introduziu o conceito de quantum de energia (hf) para explicar a radiação do corpo negro. Einstein usou a idéia do quantum para explicar o efeito fotoelétrico, sugerindo que a luz é composta de partículas chamadas fótons. Isso estabeleceu a natureza dual da luz.