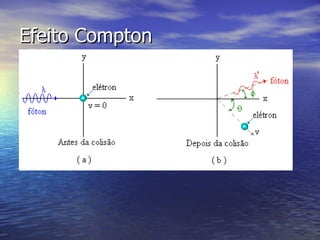
1) A teoria quântica explica fenômenos como o efeito fotoelétrico considerando que a luz é composta de "partículas" chamadas fótons, que transferem quantidades discretas de energia aos elétrons.
2) Einstein propôs que cada fóton possui uma energia hf e que esta energia é transferida integralmente a um elétron, possibilitando sua ejeção do metal.
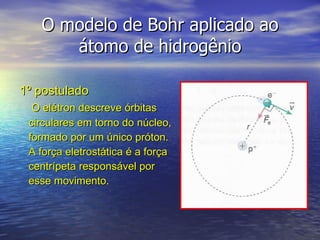
3) O modelo atômico de Bohr aplicado ao hidrogênio postulou que os elétrons orbitam o nú