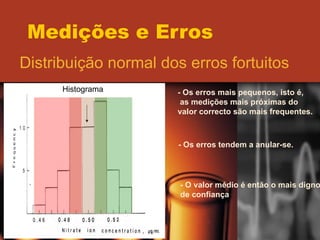
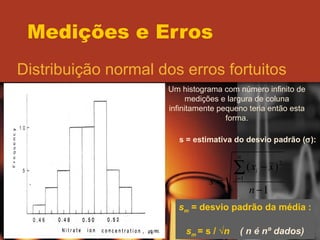
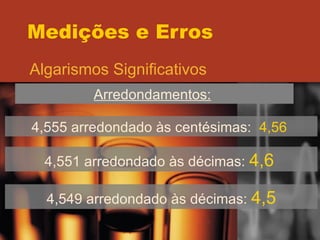
O documento discute os conceitos de medições e erros, incluindo erros sistemáticos e aleatórios, precisão versus exatidão, distribuição normal de erros, desvio padrão, intervalo de confiança, algarismos significativos e propagação de erros. Vários exemplos ilustram esses conceitos-chave.






![Medições e Erros Distribuição normal dos erros fortuitos EXEMPLO : Calcular o desvio padrão e o desvio padrão relativo do seguinte conjunto de medições: 0,102 0,105 0,100 0,103 0,100 1º- Calcular a média: = (0,102+0,105+0,100+0,103+0,100)/5 = 0,102 2º- Calcular o desvio padrão: s = [(0,102-0,102) 2 +(0,105-0,102) 2 +(0,100-0,102) 2 + (0,103-0,102) 2 +(0,100-0,102) 2 /(5-1)] 1/2 = 0,0021 3º- Calcular o desvio padrão relativo: RSD = (s/ )x100% = (0,0021/0,102)x100% = 2,1%](https://image.slidesharecdn.com/medieseerros-100905161129-phpapp02/85/Medicoes-e-erros-9-320.jpg)




















![Medições e Erros Algarismos Significativos Problemas: m = 2,5401 g + 0,57 g + 253,1 g C = (0,55 g / 231,22 g mol -1 ) / (25,00x10 -3 dm 3 ) pH = -log [H + ], [H + ]=0,0876 M](https://image.slidesharecdn.com/medieseerros-100905161129-phpapp02/85/Medicoes-e-erros-31-320.jpg)
![Medições e Erros Propagação de erros aleatórios No caso de uma combinação linear: Y = k + k a a + k b b + …. e Y = [(k a e a ) 2 + (k b e b ) 2 + …] 1/2 Por exemplo: volume gasto na bureta: volume inicial: 5,44 ± 0,02 cm 3 volume final: 22,04 ± 0,02 cm 3 volume gasto = vol.final – vol.inicial = 22,04 – 5,44 = 16,60 cm 3 e(volume gasto) = (0,02 2 + 0,02 2 ) 1/2 = 0,028 cm 3](https://image.slidesharecdn.com/medieseerros-100905161129-phpapp02/85/Medicoes-e-erros-32-320.jpg)

![Medições e Erros Propagação de erros aleatórios No caso de uma expressão multiplicativa: Y = k.ab/cd e Y = Y. [(e a /a) 2 + (e b /b) 2 + (e c /c) 2 + (e d /d) 2 ] 1/2 Então para o caso da solução de NaCl: e |NaCl| = |NaCl|. [(e massa /massa) 2 + (e Vol /Vol) 2 ] 1/2 = 0,08416. [(0,0002/0,4587) 2 + (0,06/50) 2 ] 1/2 = = 0,08416. (1,98987e-7 + 0,00000144) 1/2 = 0,000108 g/dm 3](https://image.slidesharecdn.com/medieseerros-100905161129-phpapp02/85/Medicoes-e-erros-34-320.jpg)



![Medições e Erros Propagação de erros aleatórios y = a k e y = y.[k.e a /a] y = ln a e y = [e a / a] y = log a e y = [e a .log e / a] = [e a 0,4343 / a]](https://image.slidesharecdn.com/medieseerros-100905161129-phpapp02/85/Medicoes-e-erros-38-320.jpg)

![Medições e Erros Propagação de erros aleatórios RESOLUÇÃO Sendo pH = - log [H + ], e atendendo à expressão do cálculo de erro apresentada anteriormente, o erro de precisão no pH é de: (0.0004 x 0,4343) / 0,0940 = 0,001(8) = 0,002 Resultado final: pH = 1,027 ± 0,002](https://image.slidesharecdn.com/medieseerros-100905161129-phpapp02/85/Medicoes-e-erros-40-320.jpg)

