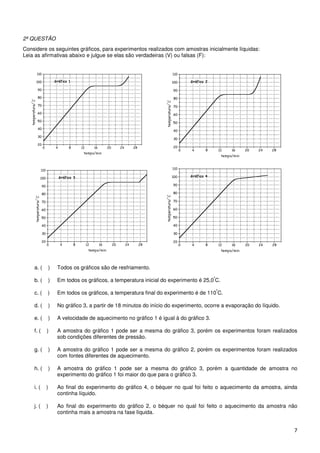
Este documento apresenta um material didático sobre química para estudantes do ensino médio. Ele inclui questões sobre propriedades de substâncias como etanol, água, dióxido de carbono e amônia, representações de moléculas e mudanças de fase durante resfriamento e aquecimento.