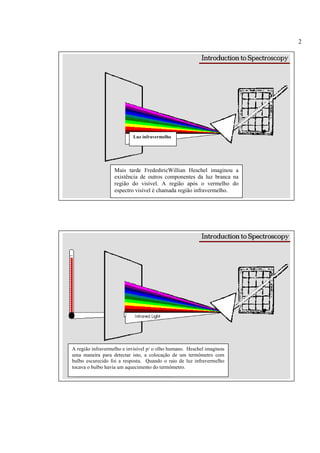
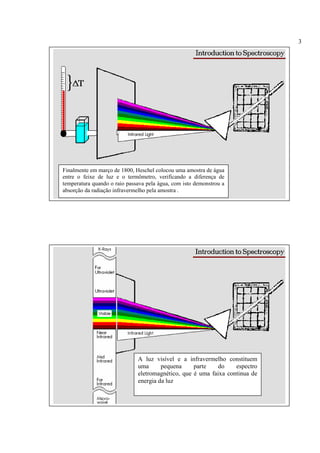
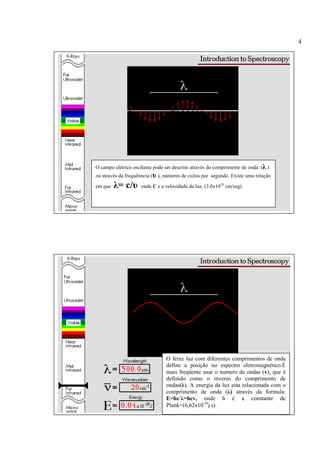
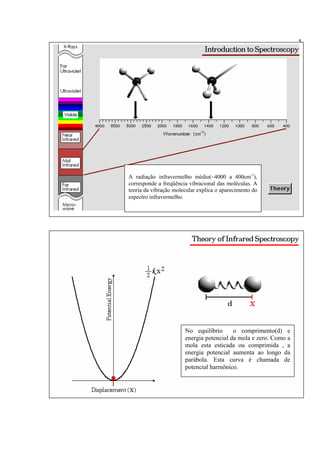
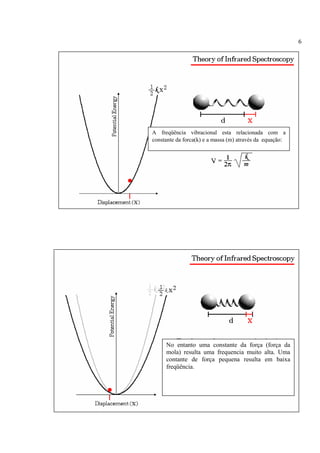
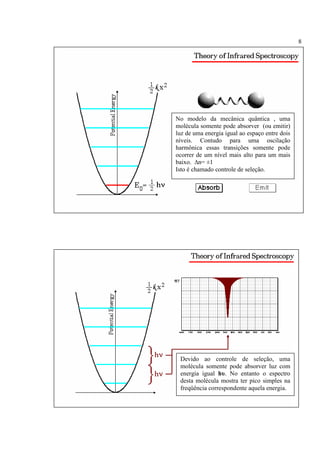
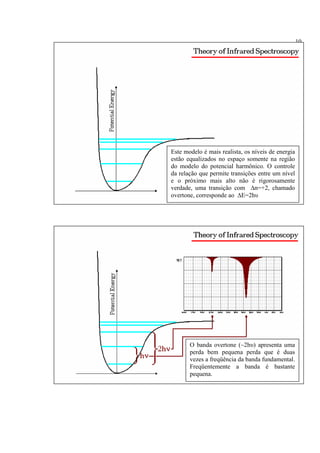
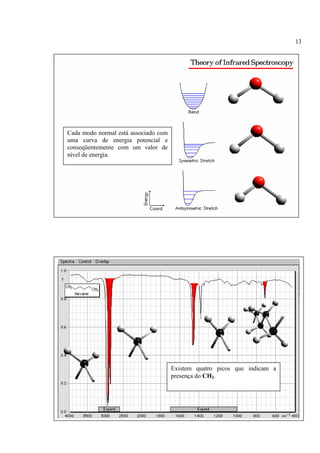
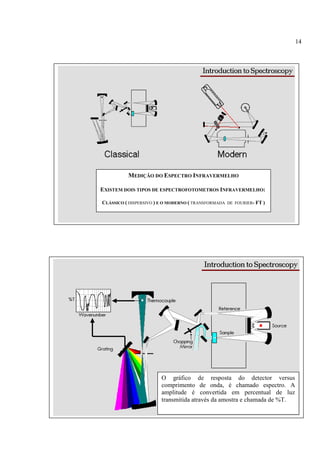
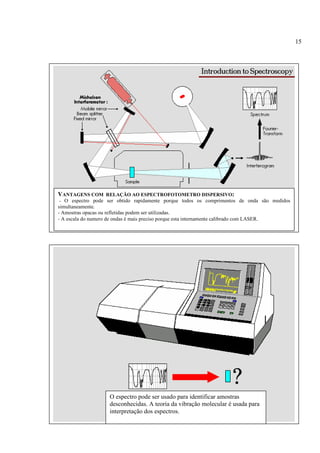
A espectroscopia infravermelho mede a absorção de radiação eletromagnética por moléculas. Moléculas absorvem energia quantizada igual a hυ durante transições vibracionais e de rotação. O espectro infravermelho fornece informações sobre os modos normais de vibração e identidade química de uma amostra.