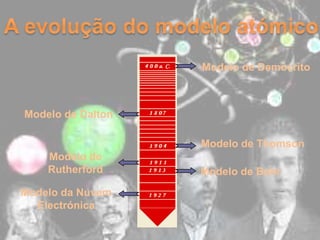
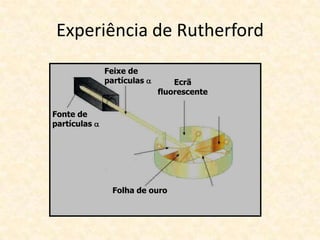
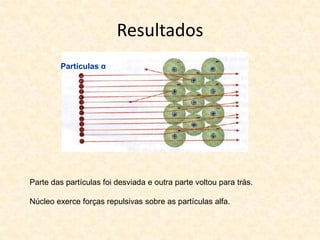
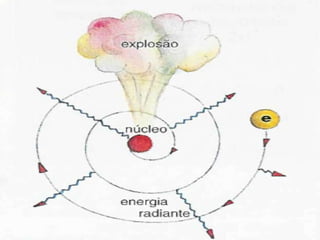
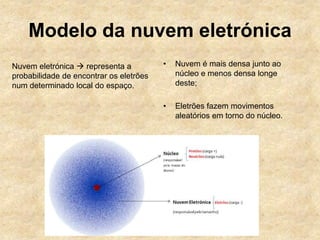
O documento descreve a evolução dos modelos atômicos ao longo do tempo, começando com o modelo de Dalton que propôs que os átomos eram indivisíveis e constituíam os elementos químicos. Posteriormente, o modelo de Thomson propôs que os átomos eram esferas com carga positiva contendo eletrões. Já o modelo de Rutherford, baseado em seus experimentos, indicou que os átomos possuem um núcleo denso no centro. Finalmente, os modelos de Bohr e da nuvem eletrônica desc