1) O documento discute a transferência de massa, que é análoga à transferência de calor em muitos aspectos. A força motriz para a transferência de massa é a diferença de concentração, assim como a diferença de temperatura é a força motriz para a transferência de calor.
2) A difusão é o mecanismo principal de transferência de massa, onde as espécies se movem de regiões de alta concentração para baixa concentração. A taxa de difusão de massa é proporcional ao gradiente de concentração








![§Fi ..!:.;,§C
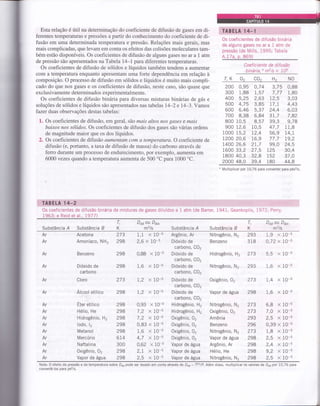
Os coeficientes de difusão binária de soluções de líquidos diluídos e soluções sólidas a I atm (de Barrer, 1941; Reio;:
a|.,7977; Thomas, 1991; van and Black, 1980)
(a) Difusão através de líquidos
Substância / Substância B T, K Dor, mzls
(sol utos) (solvente)
b) Difusão através de sólidos
Substância .4 Substância B
(solutos) (solvente)
T, K Dor, m?!s
Amônia
Benzeno
Dióxido de
carbono
Cloro
Etanol
Etanol
Etanol
G licose
Hidrogênio
Metano
Metano
Metano
Metanol
N itrogên io
0xigênio
Agua
Agua
Agua
Clorofórmio
Água
Água
Agua
Água
Água
Água
Agua
Agua
Água
Agua
Agua
Agua
Agua
Água
Água
Etanol
Etileno glicol
Metanol
Metanol
1,6 x 10-e
1,0 x10 e
2,O x10s
1,4 x10 e
0,84 x 10 e
1,0 x10 e
1,2 x10 e
0,69 x 10 e
6,3 x 10-s
0,85 x 10 e
1,5 x10 e
3,6 x10e
1,3 x10e
2,6 x 10-e
2,4 x 10-e
1,2 x 10-e
0,18 x 10-e
1,8 x 10-e
2,L x10e
Dióxido de
carbono
Nitrogênio
Oxigênio
Hélio
Hélio
Hélio
H idrogên io
Hidrogênio
H id rogên io
Cádmio
Zinco
Zinco
Antimônio
Bismuto
Mercúrio
Cobre
Cobre
Carbono
Carbono
Borracha natural
Borracha natural
Borracha natural
Pirex
Pirex
Dióxido de silício
Ferro
N íq uel
N íquel
Cobre
Cobre
Cobre
Prata
Chumbo
Chumbo
Alumínio
Alumínio
Ferro (fcc)
Ferro (fcc)
298 1,1 x 10-r:
298 1,5 x 10-::
298 2,1x lC-:i
773 2,0 x 10-r
293 4,5 x 1C-::
298 4,0 x 1C-:"
298 2,6 x !O-r?
358 1,2 x 7O-';
438 1,0 x 10-::
293 2,7 x lO-re
773 4,0 x 10-:E
1273 5,0 x 10--
293 3,5 x 10-E
293 1,1 x 10-z
293 2,5 x 10-:§
773 4,0 x 1G-:'
t273 1,0 x 10-r;
773 5,0 x 10-:=
1273 3,0 x 1O-::
285
293
298
285
283
288
298
298
298
275
293
333
288
298
298
298
298
298
288
Em uma mistura binária de gás
ideal de espécies A e B, o
coef iciente de difusão de A em B é
igual ao coef iciente de difusão de B
em ,4, e ambos aumentam com a
temperatura
DHrg-4y Otl DAr-Hro
em 1 atm, em m2ls
I, 'C (a partir da
EquaÇão 14-15)
Devido a sua importância prática, a difusão de vapor d'dgua na atmofuú
tem sido o tema de vários estudos e algumas fórmulas empíricas têm sido &
senvolvidas para o coeficiente de difusão Dn,o_*. Marrero e Mason (1972t p.
puseram esta fórmula popular (Tabela 144)1
Dr,o-* : 1,87 x lo-nTz'otz (m2is), 280 K < r< 450 K (lrt-:T5
onde P é a pressão total em aÍmeT é a temperaturaem K.
O principal mecanismo motriz da difusão de massa é o gradiente de conm
ção e a difusão de massa devido a um gradiente de concenffação é conhecidam
difusão ordinária. No entanto, a difusão também pode ser causada por ffi
efeitos. Os gradientes de temperatura em um meio podem causar difusão tfuúr
(também chamado de efeito soret) e gradientes de pressão podem resultar em Õ
fusão de pressão. Ambos estes efeitos são geralmente insignificantes, entrm
a menos que os gradientes sejam muito grandes. Em centrífugas, o gradiem &
pressão gerado pelo efeito centrífugo é usado paÍa separar soluções iíqúdas e É-
topos gasosos. Um campo de força externo, como um campo elétrico ou um cqm
magnético aplicado sobre uma mistura ou solução, pode ser usado com sm
para sepaÍar moléculas eletricamente carregadas ou magnetizadas ou (como m
um eletrólito ou gás ionizado) a partir da mistura. Isto é chamado de difrrsibh-
çada. Além disso, quando os poros de um sólido poroso como a sílica-gel §o
menores que o caminho médio livre das moléculas do gás, as colisões moleculm
podem ser desprezíveis e um fluxo de moléculas livres pode ser iniciado. Is c
conhecido como difusão de Knudsen. Quando o tamanho das moléculas do EísÉ
0
5
10
15
20
25
30
35
40
50
100
150
2,09 x 10-5
2,17 x t0 5
2,25 x lO 5
2,33 x 10-5
2,42 x lO-5
2,50 x 10-5
2,59 x 10-5
2,68 x 10-5
2,77 x l]-s
2,96 x 10-5
3,99 x 10-5
5,18 x 10-5](https://image.slidesharecdn.com/engel-capitulo14-161107223251/85/cEngel-capitulo-14-10-320.jpg)

![Superfície
isolada
Superfície
impermeável
de ar nos dois lados de uma interface ar-água, no entanto, são obviamenle - Jrltli
diferentes (na verdade, a concentração de ar flaíLgua é próxima de ze:- l';
mesmo modo, as concentrações da água nos dois lados de uma interface ::-:jrIilü
também são diferentes, mesmo quando o aÍ está saturado (Figura 1-l-i-: ?.r'
tanto, ao especificar uma condição contorno, especificar o local não é su :: r-rtc
Precisamos também especificar o lado do contorno. Parafazer isso. col.-st'
mos duas superfícies imaginárias nos dois lados da interface Que e stàrr ::--'-1 u
simalmente perto da interface. Quando existe uma dúvida, vamos indie':: - -lr-a,r
desejado da interface, especificando a sua fase como um subscrito. Pc': ='t::lt-
plo, a concentração da água (líquido ou vapor) nos lados do líquido e c,l i' IE
uma interface ar-ágta em Í = 0 pode ser expressa em uma base molar : -:.,-
)uro, taao tiquiao (0) : Yr e )Hro, tuao guroro(0)
: )': eÊ
Usando a lei de Fick, a condição de contorno de fluxo de espécie.-'-r:;ü11Íi:
paÍa uma espécie Á difundindo em um contorno em ir = 0 é expressa- i-: 1 §sr*
cia de qualquer injeção ou sucção, como
Át^l
-CDorâ1._r: io.,
ondeTo,o e7o,0 são os fluxos molar e de massa especificados da espécie 1
torno, respectivamente. O caso específico de fluxo de massa zero (i | =
corresponde a uma superflcie impermeável paÍa a qual dya(0) ldr = dt" . '.
(Figura 14-14).
Para aplicar a condição de contorno de concentração especificcdc. :=='-"" ur
conhecer a concentração da espécie no contorno. Esta informação é g::-:trrue
obtida a partir da exigência de que deve existir tm equilíbrio iennod;c:- , ta
interface das duas fases de uma espécie. No caso de uma interface ---.l rf!
valores de concentração de vapor d'água na atmosfera são facikneni= lr:'r3-l[]tr'*
nados a partir dos dados de saturação, como mostrado no Exempio 1:-l
EXEMPLO I4_2 Fração molar d0 vapoÍ de água na superfíciG
de um lago
Determinar a fraçáo molar do vapor d'água na superfície de um lagc l--,i Em-
peratura é de 15'C e compará-la à Íração molar da água no lagc (F í-=:'ü-
15). Considerar a pressão atmosférica no nível do lago de 92 kPa.
dw^l
-PDeail,=o: i,
- dc,(0)
dx
/uo1O) = O
-=l
-- )
-3--il
-ry
FIGURA 14-14
Uma superfície impermeável em
transferência de massa é análoga a uma
superfície isolada na transferência de
calor.
Ar
92 kPa, 15 'C
Ar saturado
(:::::'::_ = 0.0185
T&bo,radii&;idq =1,0I,ago
.l-5 0c
FTGURA 14-15
Esquema para o Exemplo l4-2.
S0tUçÃ0 Determinar a fração molar do vapor d'água na superfície c: -
e comparar com a fração molar da água no lago.
Suposições 1 Ambos, o ar e o vapor d'água, são gases ideais. 2 AÍra;a-
do ar dissolvido na água é desprezível.
Propriedades A pressão de saturação da água a 15'C é de 1,705 i('a
A-9).
Análise 0 ar na superfÍcie da água está saturado. Portanto, a pressa: :ar:a 3E
vapor d'água no ar na superfície do lago é simplesmente a pressão de -:lra@
da água a 15'C,
Prupo, : Psat a 15.c : 1,705 kPa
Supondo que ambos, o ar e o vapor, são gases ideais, a fração mc a' l: *amrr
d'água no ar na superfície do lago é determinada a partir da Equaçã: -t'-l-
como
P,upo, 1,705 kP"
.)uupo.: ;: jffi: 0'0185 (ou 1,85%)
-rtfiffi
ffi
L....*"
t-'](https://image.slidesharecdn.com/engel-capitulo14-161107223251/85/cEngel-capitulo-14-12-320.jpg)
![s o montante é insignificante'
A água contém um pouco de ar dissolvido'.m3
Portanlo, podemos assumir que a totalidade do lago seja água líquida' Enião' a
sua fração molar se torna
)água'lrdolíquido = 1'0 (ou 100%)
Discussão Note que a concentração de água,numa base molar é 100% logo
;;rj;;; inteiia.á ar-água, e t,8s% logo acima dela' mesmo Çue o ar seja
.ãniiO"ruOo saturado (pãr isso este é o valor mals elevado a 15'C). Portanto,
il;;;;;,;i sràro.; descontinuidades nas concentrações de uma espécie
através dos contornos.
Asituaçãoésemelhantenasinterfacessólido.líquido.Maisumayez,a
uma determinada temperatura, apenas certa quantidade de sólido pode ser
dissolvida em um líquido e a solubilidade do sólido no líquido é determinada
a partir da exigênciá de que exista um
-equilíbrio
termodinâmico entre o só-
tào e a soluçào na interface. A solubilidade represerlta a quantidade má-
xima de sólido que pode ser dissolvida em um líquido a uma determinada
temperatura
"
erta ámptamente disponível em manuais de química. Na Ta-
bela 14-5 apresentamos uma amostia de dados de solubilidade de cloreto de
sódio (NaCi) e bicarbonato de cálcio [ca(HCO:)z] em diferentes.temperatu-
ras. Por exemplo, a solubilidade do sal (NaCl) em água a 310 K é de 36'5 kg
porl00kgdeágua.Portanto,afraçãodemassadosalnasalmouranainter-
façe é simPlesmente
TABELA 14-5
Solubilidade de dois comPostos
inorgânicos em água a drferentes
temperaturas, em kg Por 100 kg de
água lde Handbook of ChemistrY
(Nova York: McGraw-Hill. 1961)l
Soluto
B icarbonato
Tempera- Sal, de Cálcio,
tura, K NaCl Ca(HCOa)z
m"a _ 36,5k9 :0,267
wsal,lado liquido m (100 + 36,5) kc
(ot26,7%)
273,15
280
290
300
310
)a^
330
340
350
360
370
373,75
35,7
35,8
35,9
36,2
36,5
36,9
5t,z
37,6
38,2
38,8
39,5
39,8
I6,1 5
i6,30
16,53
16,75
i6,98
17,20
t7,43
t7,65
t7,88
18,10
i8,33
18,40
enquanto a fração de massa de sal no sal sólido puro é
'"r'
= 1'0 Note que a água
se toÍra saturadacom sal quando 36,5 kg de sal são dissolvidos em 100 kg de
étgua a 3i0 K.
Muitos processos envolvem a absorção de um gás em um líquido' A maior
parte dos gases é pouco solúvel em líquidos (como o ar na água) e para essas
iotuç0", dltuidus âs frações molares de uma espécie I nas fases gás e líquida na
int"rfaCe são prOpOrCiOnais UmaS àS OUtraS, oU Seja, )l,ludo gu.oro.n )i,tuao liq'iao Oll
P,,luoo *ornro
oc P,i,lrdo llquido
já 9ue );,lu'lo gu*1o = P''tutlo-'ototo/P para misturas de gases
id;ir: Ê;t" é óonhecida como a lei de Henry e é expressa como
P, l",lo *",otu
.vi. lriLo lrquiLlo H
onde 11 é a constante de Henry, que é o produto da pressão total da mistura
de gases e da constante de propoicionalidade. Para uma determinada espé-
cie, ela é uma tunção up",tui dà temperatura e é praticamente independente
da pressão para pressõãs inferiores a cerca de 5 atm' Os valores da cons-
tante de Henry para algumas soluções aquosas são apresentados na Tabela
14--6 paradiversas tem-peraturas' óesta tabela e da equação acima' fazemos
as seguintes observações:
1. A concentração de um gás dissolvido em um líquido é inversamente
proporcionai à constanie de Henry' Portanto' quanto maior for a
constante de Henry, menor será a concentração dos gases dissolvidos
no líquido.
(14-1 8)](https://image.slidesharecdn.com/engel-capitulo14-161107223251/85/cEngel-capitulo-14-13-320.jpg)






![Avazãa mássica é determinada pela multiplicação dauazão molar pe!a -z=a
molar do hidrogênio, que é M = 2 kg/kmol,
rit6i1 : MN6,1: (2 kgikmol)(1,228 X 10-ldkmoys) : 2,46 x 10 1! kg:
Portanto, o hidrogênio vai vazar para fara através da casca do recipie-:: :n:r'
dif usão a uma taxa de 2,46 x 10'10 kg/s ou 7,8 glano. Note que a conce-:'a:Í
de hidrogênio no níquel na superfície interna depende da temperatu... )t
pressão do hidrogênio no tanque e pode ser determinada conforme ex: :3:l;
no Exemplo 14-4. Além disso, a hipótese de concentração nula de h;c'-'-:i- :
no níquel na superfície externa é razoável, uma vez que existe apen?s --3
quantidade ínfima de hidrogênio na atmosfera (0,5 parte por milhão ern ---e--
ros de mol).
14-6 * MIGRAçÃ0 DE VAPoR DE ÁGUA EM EDIFICAo0ES
A umidade influencia fortemente o desempenho e a durabilidade ;
riais de construção e, portanto, a transmissão da umidade é um aspe.-l.
tanle paÍa a construção e manutenção de edificações.
As dimensões da madeira e de outras substâncias higroscópicas mui::- - -r'rt
teor de umidade. Por exemplo, uma variaçáo de 4,57a no teor de umtc::: -e
com que o volume da madeira de carvalho branco mude em 2,5%. Es." ::r-
danças cíclicas das dimensões enfraquecem as junções e pode colocar il-: --- r
a integridade estrutural dos componentes de um edifício, causando "r;:J-:J.
no mínimo. O excesso de umidade também podem causar mudanças n" --:' -:"r-
cia e propriedades físicas dos materiais: corrosão e ferrugem em mi-:- i Jl'ii F
drecimento em madeiras e descascamento da pintura nas superfície! l:- --.-1"1 1
exterxa das paredes. Madeira embebida com um teor de água de l]r-j r -:, ";
degrada-se rapidamente a temperaturas de 10 a 38 'C. Além disso..nr,:i. :'-:-
cem em superfícies de madeira em umidades relativas superiores a S-<'-, :. .
pansão da água durante o congelamento pode danificar a estrutura i:,- r- iu
materiais porosos.
O teor de umidade também afeÍa a condutividade efetiva dos me:. i :r.f*""
sos, como solos, materiais de construção e isolamentos e, portanto. : l-j :i1 r
rência de calor através deles. Vários estudos têm indicado que a trar-.:--l::^
de calor aumenta quase linearmente com o teor de umidade. a urn; l'x,r id
37o a 57o para cada aumento percentual no teor de umidade em vol-::,: --
m
isolamento com 57o de umidade em volume, por exemplo, aumenl; ; ::illrr-
ferência de calor em l57o a 25Vo em relação ao isolamento seco , -{: -r-r 1
Handbook of Fundamentals, 1993, Capítulo 20) (Figura 14-24). -{ :-- -r-,or
de umidade também pode servir como um mecanismo de transterêr-- : :rfi:
o calor latente alternando a evaporação e a condensação. Duraçt: -:l 'rir-
quente e úmido, por exemplo, o vapor d'ág:ua pode migrar atrae! :: -.;rr-
parede e condensar na face interna, liberando o calor de vaporizaçl - - : : r'l r
processo invertendo durante uma noite fria. O teor de umidade tam:<: L :'ld
o calor especffico e, assim, as características de armazenamento cie : : , - r 'r
materiais de construção.
A migração de umidade nas paredes, pavimentos ou tetos em e;--.- - :
em outras aplicações é controlada seja pelas barreiras de vapor. := : :Í: ' "
retardadores de vapor. Barreiras de vapor são materiais impdl-r:-=. :r 'l
umidade, como as folhas de metais, folhas de metais pesados e cÊIt-:_:: Í-
l.-
Isolamento
seco
Isolamento
molhado
( (
', , ::. ,
,,,:j"I. '
l25A
)
0%
umidade
FIGURA 1+24
Uma umidade de 5% pode aumentar em
25Va a Íratsferência de calor através do
isolamento de uma parede.
,, ,rt - .'
l
5Vo
umidade](https://image.slidesharecdn.com/engel-capitulo14-161107223251/85/cEngel-capitulo-14-20-320.jpg)

![t.UÂ-OF0,l,l,,4i [0,. 1.,,,,,, 1..,
]:ir.rr.1,..
Permeação de vapor tÍpica de
materiais de construção comuns
(de ASHRAE, i993, Capítulo 22,
Tabela 9)*
Materiais e suas Permeação
espessuras ng/s' m2 ' Pa
Concreto (1:2:4
mistura, 1lh) 4,7
Tijolo, alvenaria,
100 mm 46
Gesso sobre
estrutura metálica,
19 mm 860
Gesso sobre estrutura
de madeira, 19 mm 630
Gesso sobre sarrafos
de madeira,9,5 mm 2860
Madeira compensada,
6,4 mm 40-109
Arparado,lm 174
lsolamento de lã
mineral
(desprotegido), 1
lsolamento de
placas de
pol i uretano
expandido, 1 m
Folha de alumínio,
0,025 mm
Folha de alumÍnio,
0,009 mm
Polietileno,0,051
mm
m 245
Polietileno, O,2 mm
Poliéster, 0,19 mm
Tinta látex
retardadora de
vapor, 0,070 mm
Tinta acrÍlica para o
exterior de casas e
arremates, 0,040
mm 313
Papel de parede,
unidade de massa
0,16-0,68kg/m2 O,l-240O
* Os dados variam muito. Consultar os
fabricantes para obter dados mais precisos.
Multiplicar por 1,41 x 10-6 para converter para
lbmis . pé2 . psi. Também, 1 ng = 16rz 1t.
A permeabilidade da maioria dos materiais de construção é geralmente 3-..'
pressa paÍa uma determinada espessura, em vez de por unidade de espess-'
Isto é chamado de permeaçáo trl", que é a relação entre a permeabilidade :-
material e a sua espessura. ou seja,
Permeabilidade
Permeação :
Espessura
(kg/s'm2'Pa)
(kg/s) t11 1a
construção comuns é dada na Tat'<-.
ob
fl":; i1. --'
A recíproca da permeação é chamada de (unidade) resistência de vapor:
expressa como
Resistência de vapor : #"*
rÍ, -
Note que a resistência de vapor
transmissão de vapor de água.
(s'm2'Pa/kg)
representa a resistência de um materi"-
Deve-se salientar que a quantidade de umidade que entra ou sai de um eú::--
cio por difusao geralmente é insignificante em comparação com o montante cJ:
entra com ainfiltração de ar oa sai com o vazamento de ar. O principal mod-. -
de interesse na difusão de umidade é seu impacto sobre o desempenho e a i.':-
gevidade dos materiais de construção.
A resistência de vapor global de uma estrutura de edifício composta que .c':-
siste em várias camadas em série é a soma das resistências das camadas in,ii. --
duaiseéexpressacomo
Rr.total : Rr.t + Âr.2 +' i Rr.r: ) Rr,, i l-F
Então, a taxa de transmissão de vapor através de uma estrutura cc:-
posta pode ser determinada de uma maneira análoga à transferência ::
calor a partir de
AP.,
,ir" : A
R_*,
A permeação de vapor de materiais de
t4-t0.
IL
.ilw
0,58-2,3
0,0
2q
9,1
2,3
4,6
ZO
EXEMPL0 l4-6 Condensação ê congelamento de
umidade nas paredes
A condensação e até mesmo o congelamento de umidade nas paredes se:-
um retardador de vapor efetivo é uma preocupação real em climas frios e que
compromete a eÍicácia dos isolamentos. Considerar uma parede de moldura oe
madeira que foi construída em torno de vigas de madeira de 38 mm x 9i
mm (2 polegadas x 4 polegadas nominais). A cavidade de 90 mm de largura
entre as vigas é preenchida com isolamento de fibra de vidro. O interior está
acabado com placas de gesso de 13 mm e o exterior com painéis de fibras ae
madeira de 13 mm e com tábuas de madeira de 13 mm x 200 mm sobrepostas-
Utilizando os dados do fabricante, as resistências térmicas e de vapor dos vários
componentes para uma unidade de área da parede são](https://image.slidesharecdn.com/engel-capitulo14-161107223251/85/cEngel-capitulo-14-22-320.jpg)
![1. Superfície externa, 24 km/h vento 0,030
2. Tábuas de madeira sobrepostas e pintadas 0,14
3. Painéis de fibra de madeira , 13 mm
4. lsolamento de fibra de vidro, 90 mm
5. Placas de gesso pintadas , 13 mm
6. Superfície interna, ar parado
TOTAL 3,05 0,0452
As condições internas são 20 "c e 60% de umidade relativa, enquanto as
condições externas são -16 "c e7o% de umidade relativa. Determinar se vai
ocorrer condensação ou congelamento de umidade no isolamento.
s0tuç40 A resistência térmica e de vapor das diferentes camadas de uma
parede são dadas. lnvestigar a possibilidade de congelamento ou condensação
de umidade na parede.
suposições L Existem condições de funcionamento permanentes. 2 A transfe-
rência de calor através da parede é unidimensional. 3 As resistências térmica e
de vapor das diferentes camadas da parede e o coeficiente de transferência de
calor são constantes.
Propriedades As resistências térmicas e de vapor são dadas no enunciado do
problema. As pressões de saturação de água a 20 "C e -16.C são 2339 pa e
151 Pa, respectivamente (Tabela 14-9).
Análise um esquema da parede e os diversos elementos utilizados na sua cons-
trução são apresentados na Figura 14-25. A condensação é mais provável de
ocorrer na parte mais fria do isolamento, que é a parte adjacente à proteção ex-
terna. Notando que a resistência térmica total da parede é de 3,05 m2 . .C
/W,
a taxa de transferência de calor através de uma unidade de área A= 1m2 da
parede é
FIGURA 14_25
Esquema para o Exemplo 14-6.
Valor R, Valor - R,,
Construção mz . "C/W s.mz .pâlnp.o
0,23
2t
0,079
o,12
0,019
0,0138
0,0004
0,012
[20 - (-16)"C]
:11.8W
3,05 m2 "C^V
A resistência térmica da parte externa da parede além do isolamento é de
0,03 + 0,14 + O,23 =O,4A m2. 'C/W. Entã0, a temperatura da interface entre
o isolamento e a proteção externa é
Tr: To + Qp*"a"R"*, : -16 "C+ (11,8 WX0,40 "CÃq: -11,3 "C
A pressão de saturação da água a -1 1,3 'C é de 234 pa, como mostra a Ta-
bela 14-9, e se houver condensação ou congelamento, a pressão de vapor na
interface entre o isolamento e a proteção externa será este valor. A pressão de
vapor no interior e no exterior é
P,,r: ôtP"ut,1 : 0,60 x (2340 Pa) : 1464 t*
P,.z : ózP,ur. t: 0,70 x ( t5 I Pa) : 106 Pa
Então, a taxa de fluxo de umidade através das partes interna e externa da
parede torna-se
Qp .a":
^#:1t
m2)](https://image.slidesharecdn.com/engel-capitulo14-161107223251/85/cEngel-capitulo-14-23-320.jpg)
![ú''inreior: o(ff),,,.""
,: o?::
: (1mr)
(t4o4 - 234)Pa
(0,012 + 0,0004) Pa . m2 s/ng
= 94355 ng/s: 91._r p=.:
. ./AP Pu.r-Pu.z
flv'erterior : o[
o, /"-,"r",
: o
****
: (t m2)
(234 - 106) Pa
(0,019 + 0,0138) Pa m2 s/ng
: 3902 ng/s : 3.9 1r: '
ou seja, a umidade está fluindo em direção à interface a uma taxa de 9j
mas está fluindo da interface para o exterior a uma taxa de apenas 3
Notando que a pressão na interface não pode exceder 234Pa, estes res-
indicam que a umidade está congelando no isolamento, a uma taxa de
âr,"org"lu*"rto : úv,írte;,q - ht,extenor : 94'4 - 3'9 :90'5 pg s
Discussão Este resultado corresponde a 7,82 g durante um período i: 'a -
que pode ser absorvida pelo isolamento ou pela proteção e, então, esccâ' :,8ã
fora quando as condições melhorarem. No entanto, o excesso de ccr.:=-sa:à:
(ou congelamento em temperaturas abaixo de 0 "C) de umidade nas::'"1=
frias durante longos períodos podem causar sérios problemas. Este ?..= ?-ií
pode ser evitado ou minimizado, instalando barreiras de vapor sobre : 3,:: r-
terno das paredes, que limitarão avazão de umidade a 3,9 pg/s. Noie :-= r:
não houvesse condensação ou congelamento, avazão de umidade 3i.3,€s tE
uma secção de 1 m2 da parede seria de 28,7 pgls (você pode verificar ---
14_7 * DIFUSAO DE MASSA TRANSIENTE
A análise permanente discutida anteriormente é útil para se dei;:_. :,u -
taxa de vazamento de uma espécie através de uma camada e stacio: .-' , '*';;
às vezes estamos interessados na difusão de uma espécie em um . :, "1r"
rante um tempo limitado antes que as condições operacionais pi::: -:r ri:
sejam estabelecidas. Tais problemas são estudados utilizando u:-. a-u.r'iLri'c
transiente. Por exemplo, a superfície de um componente de aço rn j- : - ::--r.
mente é endurecida pela imersão do componente em um materiatr r:---,Ti .r
em um forno a alta temperatura. Durante o curto período de temp.- r, . . . -r
as moléculas de carbono difundem através da superfície do comp-.-: : ii:
aço, mas elas penetram a uma profundidade de poucos milímetros. à : - - ::';.
tração de carbono decresce exponencialmente a partir da supert-t;.= ;--- .
partes internas e o resultado é um componente de aço com umj. !-:tr- -..f
muito dura e uma região no núcleo relativamente macia (Figura l:-i:
O mesmo processo é utilizado na indústria de jóias para colorir pi.ti,: - ,.:i-;
Por exemplo, uma safira clara recebe uma cor azul brilhante ao ser el:t:' - - rI
óxido de titânio e de ferro em pó e colocada em uma estufa a cerca ;. l r l -
durante cerca de um mês. As moléculas de titânio e ferro penetrar, .r.: , .- .r,e
0,5 mm na safira durante este processo. A difusão em sólidos flotrÍrrr:Í ; :
feita a alta temperatura, a fim de aproveitar os coeficientes de difus:- :,= rl; ,
'::
,__ t
F]GURA 14-26
O endurecimento de uma superfície de
um componente de aço macio através da
difusão de moléculas de carbono é um
processo de dilusão de massa úansiente.
em temperaturas elevadas e, portanto, manter o tempo de difusão er- __-
razoâvel. Essa difusão ou "dopagem" também é comumente prari,-;-, -
dução de materiais semicondutores do tipo n ou p utilizados na f:::--:,,--r ";.r;
componentes eletrônicos. Processos de secagem, como a secagen l. -r- d
madeira, produtos alimentares e têxteis constituem outra grande á:e . :: -:, -*-
ção da difusão de massa transiente.
-Tf](https://image.slidesharecdn.com/engel-capitulo14-161107223251/85/cEngel-capitulo-14-24-320.jpg)





![P = Pt * Ps = constante e isso indica qtJe sempre que a espécie A diff
em uma direção, uma quantidade igual da espécie B deve difundir na &*
ção oposta para manter a densidade (ou a concentração molar) consturL
Este comportamento é uma boa aproximação para misturas diluídas de gr
ses ou soluções diluídas de líquidos e sólidos. Por exemplo, quando r
pequena quantidade de gás difunde em um líquido, é razoá*el supor qtr
densidade do líquido se mantenha constante.
Note que, para uma mistura binâtia, w4 * we = 1 em qualquer local r lb
mando a derivada em relação à x resulta em
dwt _ _dwt
dx dx
Assim, concluímos a partir da Equação 1444 que (Figura 14-32)
Den: Dse (1{-
ou seja, no caso da concentração total constante, o coeficiente de üLF
são de uma espécie Á em B é igual ao coeficiente de difusão da espÉte
B emA.
Vamos agora repetir a análise apresentada acima com a concenrrrç5
molar C e a vazáo molar Ú. A conservação da matéria, neste caso- É *
pressa como
li: lfo * lfu
ou
pin: poioA + prvrA
Cancelando A e resolvendo para Tfornece
n: CAVA + CBVB
(ta-
(ta.t
r*I
aaoaooooooo
aaaOO-::Oa:'a:'+'ttdiÍ.A
aoaooaooooo
aOüOOü;Oaüüü+ "'diÍ.B
aaaooaooooo
ooooooooooo
n
wA=-wB
d'o
=-d'udx dx
har,n=-ka,r,t
D,tn= Dtt
FIGURA 1+32
Em uma mistura binária das espécies Á
e B, com P = pa* pB = constante, a§
taxas de difusão de massa das espécies
Á e B são iguais em magnitude e em
direções opostas.
C
C,_ C"-:TVo*Tru:leV,q+yaVa
C^ dv^ art,
je: CeV + CAVdir.A:
ê CV - CD*á : ,o( je + jà - CO*d
C" dv" dvo
ja: CnV + CBVdir.B:
C
C, - CDao
*
: rt< jo+ jà - çOrná
{lta-
onde 7 é chamada de velocidade média molar do escoamento. I.ioc 1r
V * V, a menos que as frações de massa e molar sejam as mesmrn -b
vazões molares das espécies são determinadas de forma semelhante w
N1 : CaVIA : Ce(V + Vdír,A)A : CNA + C;VúÍ.AA: N"o*,a + Ài*n
Ns: csvsA: CrO +ioo,r1A: c"vA + cillff,LA: úoo,,r + N*, otla
Usando a lei de Fick da difusão, os fluxos totais m olares j = NlAe re rú
molares de difusão N7,7podem ser expressas como
No*,o : CAVdT,AA: CAUA - nA
Noir,r : CBVüÍ.BA: Ca(W - V)A
w =wA+wB= |
0
F,
Írl].tn](https://image.slidesharecdn.com/engel-capitulo14-161107223251/85/cEngel-capitulo-14-30-320.jpg)

![Independente
da composição
da mistura
-'/r-: L -.,''- R"T
PP
P: RT: (RJW
Dependente
da composição
da mistura
HGURA 14-33
Quando a pressão total P e a
temperatura 7 de uma mistura binária
de gases ideais são mantidas constantes,
então a concentração molar C da
mistura perÍnanece constante.
Mistura de gases
+ A+B
HGURA 14-34
A difusão de vaporÁ através de um gás
B em estagnação.
io
A condição C = constante oferece uma simplificação considerável na análi§.
da transferência de massa e, portanto, é mais conveniente usar a formulaçfu
molaÍ quando se lida com misturas de gases com pressão total e temperatuÍÉ
constilrte (Figura 14-33).
Difusão de vapor através de um gás estacionário:
escoamento de stefan
Muitas aplicações de engenharia, como tubos de calor, tanques de resfrir
mento e o familiar suor envolvem condensação, evaporação e transpiração. m
presença de um gás não condensável e, assim, a difusão de um vapor atra'*
de um gás estacionário (ou em estagnação). Para compreender e analisar esses.
processos considere uma camada líquida da espécie Á em um tanque circun-
dada por um gás da espécie B, tal como uma camada de água líquida em uE
tanque aberto ao ar atmosférico (Figura 14-34), com pressão P e temperatura X
constante. Existe um equilíbrio entre as fases líquida e vapor na interface r-t =
0) e a pressão de vapor na interface deve ser igual à pressão de saturação ,àn
espécie A na temperatura especificada. Consideramos o gás insolúvel no ij-
quido e ambos, o gás e o vapor, se comportam como gases ideais.
Se o gás circundante no topo do tanque (x = L) não está saturado, a pressão áe
vapor na interface será maior que a pressão de vapor no topo do tanque (P,_; >
PeLa, portanto, !e,o) !e.L, já que le = PelP) e essa diferença de pressão ,,--rc
concentração) conduzirá o vapor para cima a partir da interface ar-água pârê r
gás em estagnação. O escoamento ascendente de vapor será sustentado prefu
evaporação da ágta na interface. Sob condições permanentes, a vazão molrr
(ou mássica) de vapor através do gás em estagnação se mantém coÍ]StâtrtÊ. t.rtu
seja,
: NalA: constante (ouje : thAlA: constante)
A pressão e a temperatura da mistura gás-vapor são constantes e, portirnrl-L ,t
densidade molar da mistura deve ser constante em toda a mistura, coni-cÍ:sÊ
indicado anteriormente, ou seja, C = Ce-t Ce = constante e é mais conseni.f,E
trabalhar com frações molares ou concentrações molares, neste caso. em lütr
das frações de massa ou densidades,já que p I constante.
Notando eue )a * ls = 1 e que l,-o) !t,,r, temos de teÍ yB,o1J61, oü:qi.r- r
fraçáo molar do gás deve diminuir para baixo na mesma proporção que a ftajn
molar do vapor deve aumentar. Portanto, o gás deve ser difundido a panir dr
topo da coluna em direção à interface do líquido. No entanto, o gás é consirb
rado insolúvel no líquido e, portanto, não pode haver fluxo líquido de ma-r-sa dc
gás para baixo. Então, sob condições permanentes, deve haver um motimaer-
ascendente de massafluida com uma velocidade média Vque seja âpenei ü
suficiente para equilibrar a difusão de ar descendente, de forma que a r-azà- i-
quida molar (ou de massa) do gás em qualquer ponto seja igual a zero. Fm .-u-
tras palavras, o movimento da massa ascendente compensa a difi:.úi
descendente e para cada molécula do ar que se move para baixo, eriste o''e*
molécula do ar que se move para cima. Como resultado, o ar parece estar r-E&g-
nado (ele não se move), ou seja,
ir: Nuu: o (ou ja : thBlA: 0)
O meio em difusão não está mais parado por causa do movimenr.- ,iu
massa. A implicação do movimento da massa do gás é que ele rrünllirar
vapor, bem como o gás para cima com uma velocidade V, o que res-rrl- -nr:
:
IJ](https://image.slidesharecdn.com/engel-capitulo14-161107223251/85/cEngel-capitulo-14-32-320.jpg)






![onde po,o é a densidade média da massa de fluido da espécie Á definida como
ppdA" (14-$7)o^,:&L"
Portanto, o perfil da diferença de concentração adimensionarizada, assim
como o coeficiente de transferência de massa, perÍnanece constante na região
completamente desenvolvida. Isto é análogo aos coeficientes de atrito e de
transferência de calor permanecendo constantes na região completamente de-
senvolvida.
Na convecção de calor, as magnitudes relativas da difusão de quantidade de
movimento e de calor nas camadas limite hidrodinâmica e térmicà são expres_
sas pelo número adimensional de prandtl, definido como (Figur a r44o)
A quantidade correspondente na convecção de massa é o número adimensio-
nal de Schmidt, definido como
Número de Schmidt: I v Difusividade da quantidade de movimentoc: DAB (14-G9)
que rcpresenta as magnitudes relativas da difusão molecular de quantidade de
movimento e de massa nas camadas limite hidrodinâmica e de concentração,
respectivamente.
o crescimento relativo das camadas limite hidrodinâmica e térmica no escoa_
mento laminar é governado pero número de prandtl, enquanto o crescimento
relativo das camadas limite hidrodinâmica e da concentr açáo égovemado pelo
número de Schmidt. um número de prandtl perto da uniàade (p. = r) indica
que a transferência quantidade de movimento e de calor por difusão são compa_
ráveis e que as camadas limite hidrodinâmica e térmica quase coincidem uma
com a o'fta. um número de schmidt perto da unidad,e (sc = r) indica que a
transferência da quantidade de movimento e de massa por dtfusão são compa-
ráveis e que as camadas limite hidrodinâmica e da conientráção quase coinci-
dem uma com a outra.
Parece que precisamos de mais um número adimensional para representaÍ as
magnitudes relativas da difusão de calor e de massa nas camadas limite térmica
e da concentração. Esse é o número de Lewis, definido como (Figur a r4])
Número de Prandtl: p1 : L :
d
Número de Lewis:
Drru.i"iA"0. A" qr"r e de movimento
ffi(14_68)
Difusividade tórmica
Difusividade de massa
(14-70)
: Sc, (J4-71)
FIGURA lM
Na transferência de massa, o número de
Schmidt desempenha a função do
número de Prandtl na transferência de
calor.
As espessuras relativas das camadas limite de velocidade, temperatura e con_
centração em escoamento laminar são expressas como
,ScrrLe : pr: D^*
*:'*
ôu"l
-
à.on"
ôu"t
^ : Pr".
à..0
FIGURA 144I
O número de Lewis é uma medida da
difusão de calor em relação à difusão de
m2qsa-
onde n = * n1.u a maioria das aplicações em todas as três relações. Estas rela-
ções, em geral, não são apricáveis às camadas rimite turburentás, já que a mis-
tura turbulenta pode, neste caso, dominar os processos de difusão.
Note que a transferência da espécie na superfície (y - 0) é por difusão ape-
nas por causa da condição de contorno de não deslizameito e o fluxo de
massa da espécie Á na superfície pode ser expresso pela lei de Fick como
(Figura 14-42)
Pr-r'C](https://image.slidesharecdn.com/engel-capitulo14-161107223251/85/cEngel-capitulo-14-39-320.jpg)

![,:inlero cle Stanton de tra.nsJerênci.a de nrussa: S1,,.,,.." :/''::"o:rssa v
rnde yé a velocidade da corrente livre no escoamento exteÍlo e a velocidade
rédia da massa de fluido no escoamento interno.
Para uma determinada geometria, o número médio de Nussert em convecção
-orçada depende dos números de Reynolds e de Prandtl, enquanto o número
:lédio de sherwood depende dos números de Reynolds e de Schmidt, ou seja,
Nu :/Re, Pr)
Sh :/(Re, Sc)
I
"n R. s.
TAB'E!.A I4-12
Analogia entre as quantidades que
aparecem na formulação e na
solução de convecção de calor e
convecÇão de massa
Convecção
de calor
Convecção de
MASSA
'iiítrtero de Nusselt:
"
títnero de Sherwood:
T
h
"conv
ôtérrica
VL"
u
SFQ, - T.) L1
v2
u
d
h"onu L"
k
f(Re, Pr)
f(Gr, Pr)
c,y,p,orw
hr...u
ô.0n"
VL
Dô - --:
v
^ sb*- p") L3.
Ur: -- .
pv'
Sc: z
Des
hr"..uL"
Re:
.rnde a forma funcional de f é a mesma para ambos os números de Nusselt e de
Sherwood, em uma dada geometria, desde que as condições de contorno térmi-
Jas e de concentração sejam do mesmo tipo. Portanto, o número de sherwood
tode ser obtido o partir da expressão do número de Nusselt, simplesmente
titbstituindo o número de Prandtl pelo número de Schmidt.Isto mostra que a
,nalogia pode ser uma ferramenta poderosa no estudo de fenômenos naturais
Tabela 14-12).
Na transferência de massa por convecção natural, a analogia entre os núme-
:os de Nusselt e de Sherwood ainda se mantém, e Sh =/(Gr, Sc). Mas o número
de Grashof, neste caso, deve ser determinado diretamente a paÍir de
Pr:
h"^",. firu..u
t,: ãü st.,,..= -ü
Nu:
Nu:
Nu:
Sh:
Sh:
Sh:
Dns
f(Re, Sc)
f(Gr, Sc)
( I z+-79)
que se aplica a ambos os escoamentos de convecção natural induzidos pela
iemperatura e/ou concentração. Note que para fluidos homogêneos (isto é, flui-
dos, sem gradientes de concentração), as diferenças de densidade são devidas
somente às diferenças de temperatura e podemos substituir Ap/p por BAT por
:onveniência, como fizemos na transferência de calor por convecção natural.
o entanto, parafluidos não homogêneos, as diferenças de densidade são devi-
das aos efeitos combinados das diferenças de temperatura e de concenÍraçõo e
)plp náo pode ser substituído por BAT em tais casos, mesmo quando estamos
çrreocupados apenas com a transferência de calor e não temos nenhum interesse
na transferência de massa. Por exemplo, águaquente no fundo de um lago sobe
ao topo. Mas quando o sal é colocado na parte inferior, como é feito em lagoas
solares, a áglua salgada (salmoura) no fundo não vai subir porque ela é mais
pesada do que a água doce no topo (Figura 1444).
Escoamentos de convecção natural induzidos pela concentração são basea-
dos na densidade das diferentes espécies em uma mistura serem diferentes. por
isso, em condições isotérmicas, não haverá convecção natural em uma mistura
de gases composta de gases com massas molares idênticas. Também, o caso de
uma superfície quente voltada para cima corresponde à difusão de um fluido
que tem uma densidade menor do que a mistura (e, portanto, subindo sob a
influência da flutuabilidade), e o caso de uma superfície quente virada para
baixo corresponde à difusão de um fluido com uma maior densidade. por
exemplo, a evaporação da áglua no ar corresponde a uma superfície quente vi-
rada para cima, já que o vapor d'água é mais leve que o ar e ele tende a subir.
{as este não é o caso da gasolina, a menos que a temperatura da mistura ar-
gasolina na superfície da gasolina seja tão alta que a dilatação térmica ultra-
passe a diferença de densidade devido à maior concentração de gasolina perto
da superfície.
gtp* - p,) L,' gtLplpt Li
UI:?
pv- v-
200c
Sem eoÍentes
convectivas .
Agua,doce
,L,4G0À
:'SOLÀRr,
7o]c' -*Pu{g*'+i&qa,,,.§$1}'u-
Sai
FIGURA 14 44
Um fluido quente no fundo vai subir e
iniciar as correntes de convecção
natural somente se sua densidade for
menor.](https://image.slidesharecdn.com/engel-capitulo14-161107223251/85/cEngel-capitulo-14-41-320.jpg)





![o que conÍirma que a aproximação de baixo fluxo de massa é válida. A taxa de
evaporação da naftalina, neste caso, é
0,012 ke
(tS>< 60;
: l'33 x 1o-5 kg/s
Então, o coeficiente de convecção de massa torna-se
'ilA, "
:
á.u*..:
m 1,33 X 10-skg/s
pA,(wt., - we.*) (1. t84 kg/mr.1(0,3 m2X4,8 x l0-4 - 0)
: 0,0780 m/s
Usando a analogia entre transferência de calor e de massa, o coeficiente mé-
dio de transÍerência de calor é determinado a partir da Equação 14-g9 como
2t3
I I pa /128,2 kg/kmol
lol325 P, ,, kglk^"r )
: o'o x lo -*
Pe," lMa
-t_t:
P M* )
.mm*up:
t:
h"6or: Pcoh
o
D*)
: (1,184 kg/m3x1007 J/kg . .C)(0,0',rO*rr(+!t Z
0,61 x
:215 Wmz.'C
Discussão Por causa da comodidade que ela oferece, a naftalina tem sido
utilizada em numerosos estudos de transferência de caior para determinar o
coeficiente de transferência de calor por convecção
14_10 * TRANSFERÊNCIA SIMULTÂNEA DE CALOR
E MASSA
Muitos processos de transferência de massa encontrados na prática ocoffem
isotermicamente e, portanto, não envolvem nenhuma transfeiência de calor.
Mas algumas aplicações de engenharia envolvem avapoizaçáo de um líquido
e a difusão desse vapor no gás em torno. Esses processos requerem a transfe-
rência do calorlatente de vaporizaçáo hyrparao iíquido a fim de vapodzá-7o e,
portanto, esses problemas envolvem a transferência simultânea de calor e
massa. Para generalizar, qualquer problema de transferência de massa envol-
vendo mudança da .fase (evaporação, sublimação, condensação, fusão etc.)
também deve envolver a transferência de calor, e as soluções desses proble-
mas devem considerar a transÍerência simultânea de calor e de massa. Alguns
exemplos de problemas simultâneos de calor e massa são a secagem, o resfria-
mento evaporativo, o resfriamento pela transpiração (ou suor), o resfriamento
por gelo seco, a combustão de gotículas de combustível e o resfriamento por
ablação durante a reentrada de veículos espaciais, e inclusive eventos ordiná-
rios, como chuva, neve e granizo. Em locais mais quentes, por exemplo, a neve
denete e a chuva evapora antes de atingir o solo (Figuru 14-51).
Para entender o mecanismo de transferência simultânea de calor e de massa,
considerar a evaporação da água de uma piscina para a atmosfera. suponha-
mos que a á,gua e o ar estão inicialmente na mesma temperatura. Se o ar está
saturado (uma umidade relativa de ó - r00vo), não haverá transferência de ca-
lor ou de massa, enquanto as condições permanecerem isotérmicas. Mas se o ar
X 10-s m2ls )*
10-s m2ls
Veículo espacial
durante a reentradâ
Evaporação
t
-::::--::::-
1-'ti:=::: C:
,:==.=======1!r
r..i.
)
(a) Ablação
(c) Secagem de roupas (d) Tubos de c;.1..:
(á) Evaporação de u::-
gotícula de chur a
dâ::r1
lili{lo;::"
.' '
[|ltti'.,,."
,($c"*'"",'
de calor
FIGURA ] :-: .
Muitos problemas enconr:ü, . :. j
prática envolvem tran:t j:j.-.-.:
simultânea de calor c r,r.:;](https://image.slidesharecdn.com/engel-capitulo14-161107223251/85/cEngel-capitulo-14-47-320.jpg)








![Analogia entre transÍerência de calor e de massa
l4-lc Como a transferência de massa difere do escoamento
da massa de fluido? A transferência de massa pode ocorrer em
um meio homogêneo?
l4-2C Como a concentração de uma substância é definida?
Como é definido o gradiente de concentração? Como a taxa de
difusão de uma substância é relacionada com o gradiente de
concentração?
l4:3C Dar exemplos para a transferência de massa (a) líquido
para gás, (á) sólido para líquido, (c) sólido para gás e (ô1 gâs
para líquido.
l4-4C Alguém sugêre que aradiaçáo térmica (ou de calor)
também pode ser vista como radiação de massa, já que segundo
a fórmula de Einstein uma transfer ência de energia na quanti-
dade E corresponde a uma transferência de massa no valor de
m = E/c2. O que você acha?
l4-5C Qual é a força motriz paru a (a) transferência de calor,
(á) fluxo de corrente elétrica, (c) escoamento de fluido e (d)
transferência de massa?
l4-6C O que as (a) reações homogêneas e (b) reações hetero-
gêneas representam na transferência de massa? A que elas cor-
respondem na transferência de calor?
DiÍusão de massa
14-7C Ambas, a lei de Fourier da condução de calor e a lei de
Fick da difusão de massa, podem ser expressas como
Q = -kA(d.T/dx). O que as quantidade t Q, t, e e 7 representam
em (a) condução de calor e (á) difusão de massa?
14-8C Marcar estas declarações como sendo Verdadeira ou
Falsa para uma mistura binrária de substâncias A e B.
-(a)
A densidade de uma mistura sempre é igual à soma
_(b)
-(c)
_(ô
-(e)
das densidades dos seus constituintes.
Arazáo entre a densidade do componente Á e a densi-
dade do componente B é igral à fração de massa do
componente Á.
Se a fração de massa do componente Á for igual ou
superior a 0,5, então, pelo menos metade dos moles da
mistura é do componente A.
Se as massas molares de A e B são iguais entre si, então,
a fração de massa de Á será igual à fração molar de Á.
Se as frações de massa de A e B são ambas 0,5, então,
a massa molar da mistura é simplesmente a média arit-
mética das massas molares de A e B.
Problemas com um "C" são conceituais e os alunos são
incentivados a responder a todos eles. Problemas com um "E" são
em unidades inglesas e os usuários do Sl (Sistema lnternacional)
podem ignorá-los. Problemas com o ícone qk são resolvidos usando o
EES e as soluções completas, juntamente com estudos paramétricos,
estão incluídas no CD anexo. Problemas com o ícone E! são de
nalureza global e devem ser resolvidos com um computador, de
preferência usando o programa EES que acompanha este livro.
l4-9C Marcar estas declarações como sendo Verdadeira cp
Falsa para uma mistura binária de substâncias Á e B.
-(a)
A concentração molar de uma mistura sempre é
igual à soma das concentrações molares dos sea-.
constituintes.
-(b)
A razáo entre a concentração molar de Á e a conrrea-
tração molar de B é igual à fração molar do corrTxa
nente A.
-(c)
Se a fração molar do componente Á é maior que 0-§-
então, pelo menos metade da massa da mistura é de
componente A.
-(ô
Se ambos A e B são gases ideais, então a fraçb de
pressão de Á é igual a sua fração molar.
-(e)
Se as frações molares de A e B são ambas 0,5, entm- r
massa molar da mistura é simplesmente a média air-
mética das massas molares de A e B.
14-10C A lei de Fick da difusão é expressa nas bases mí-s*a
e molar como m611,a = -pADo6(dws/dx) e Noir,a = -CADrsrS;.'
dr), respectivamente. Os coeficientes de difusão Ds nas dta*
relações são os mesmos ou são diferentes?
14-l1C Como a difusividade de massa de uma mistura de *
ses muda com a (a) temperatura e (á) pressão?
l4-l2c A uma determinada temperatura e pressão, você càt
que a difusividade de massa do ar no vapor d'âgua será igrul à
difusividade de massa do vapor d'ágrano ar? Explicar.
14-13C A uma determinada temperatura e pressão, você aclr
que a difusividade de massa do cobre no alumínio será igul à
difusividade de massa do alumínio no cobre? Explicar.
l4-l4c Em uma unidade de produção, os componentes ê agc
devem ser endurecidos por difusão de carbono. Você realizrie a
processo de endurecimento à temperatura ambiente ou em ÍÍÍrl
forno a uma temperatura elevada, digamos 900 'C? Por quê'-'
14-15C Alguém alega que as frações de massa e molar de
uma mistura dos gases CO2 e N2O são idênticas. Você c*-
corda? Explicar.
L4-16 Determinar a fração de massa máxima de bicarbons,o
de cálcio [Ca(HCO:)z)] na árytta a 350 K.
Resposta:0,152
L4-17 A composição do ar úmido é dada em uma base molr
como sendo 78Vo de N2, 207o de 02 e 27o de vapor d'água- De-
terminar as frações de massa dos constituintes do ar.
Respostas: 76,4% de N2, 22,4% de 02 e !,27o de H2O
14-18E Uma mistura de gases é constituída por 7 lbm de Q-
8 lbm de N2 e 10 lbm de CO2. Determinar (a) afuaçáo mássica
de cada componente, (b) a fraçáo molar de cada componente e
(c) a massa molar média da mistura.
14-19 Uma mistura de gases é constituída de 8 kmol de H; e
2 kmol de N2. Determinar a massa de cada gás e a constatrtÊ dc
gás aparente da mistura.](https://image.slidesharecdn.com/engel-capitulo14-161107223251/85/cEngel-capitulo-14-56-320.jpg)


![14-st§là"J:il*T[,".*:l]?1i
j,T'"1;,y:,tÍ:.:",:j
de perda de hidrogênio em função da fração molar do hidrogê_
nio no gás natural com a fração molar variand o de 5Vo a l5To e
discutir os resultados.
14-52 O gás hélio é armazenado a 293 Ke 500 kpa em um
tanque esférico de 1 cm de espessura e 2 m de diâmetro interno
de sílica fundida (SiO). A iárea onde está localizado o recipiente
é bem ventilada. Determinar (a) avazão mássica de hélio por
difusão através do tanqre e (D) a queda na pressão do tanqueim
uma semana, como resultado da perda de gás hélio.
14-53 Você provavelmente deve ter percebido que os balões
inflados com gás hélio sobem no ar ,o primeiro dia durante
uma festa, mas eles caem no dia seguinte e agem como balões
ordinários cheios com ar. Isso o"o.." porqo.io hétio no balão
yaza lentamente para fora através di parede, enquanto o aryaza por difusão.
, Considerar que um balão feito de borracha macia com 0,1 mm
de espessura e com um diâmetro de 15 cm quando inflado. A
pressão e a temperatura no interior do balão são inicialmente
110 kPa e 25 "C. A permeabilidade da borracha ao hélio, oxigê_
nio_e nitrogênio a 25 oC
são 9,4 x l0-r3,7,05 x 10-13 e Z,ã x
10-13 kmoUm . s . bar, respectivamente. Determinar as taxas ini_
ciais de difusão de hélio, oxigênio e nitrogênio através da pa_
rede e a fração de massa de hélio que
"r"upã
do balão durante as
primeiras 5 h, considerando que à pressaà do hélio no interior
do balãopermanece praticamente constante. Considerar que o ar
contém 2lVo de oxigênio e79Vo d,e nitrogênio por números de
moles e que as condições ambientes sao tbO kpà e 25 "C.
14-55 Gás de puro a 1 atm e 25 "C está fluindo através de
um tubo feito de borracha de 10 m de comprimento, 3 cm de
diâmetro interno e 2 mm de espessura. Deierminar a taxa na
qual N2 yazapara fora do tubo se o meio circundante ao tubo é
(a) vácuo e (b) x atmosférico a 1 atm e 25 "C comLlVo de 02
e79Vo deN2.
Respostas: (d 2,2g x 1O-10 kmol/s, (b) 4,7g x 1Ojl kmol/s
FIGURA P14-55
Migração de vapor de água em edifícios
l4-56C Considerar um tanque que contém ar úmido a 3
atm e cujas paredes são permeáveis ao vapor d,água. O ar
nos arredores a 1 atm de pressão também contém alguma
umidade. É possível que o vapor d,ágtaa partir dos arredo_
res? Explique.
l4-57C Exprimir avazáo mássica de vapor d,ágtaatravés de
uma parede de espessura Z, em termos da pressão parcial de
vapor d'água nos dois lados da parede e da permeabilidade da
parede para o vapor d, áryna.
14-5-!9 Como é que a condensação ou o congelamento de va_
p_or d'água na parede afeta a eficárciado isolamento na parede?
Como o teor de umidade afeta acondutividade térmicf efetiva
do solo?
14-599 .A migração de umidade nas paredes, pisos e tetos
dos edifícios é controlada por barreiras di vapor ou retardado_
res de vapor. Explicar a diferença entre os dois e discutir qual
é mais adequado para ser utilizado nas paredes de edifícios
residenciais.
74-60C Quais são os efeitos nocivos do excesso de umidade
sobre a madeira e componentes metálicos de uma casa e sobre a
pintura nas paredes?
l4-6lc Por que os isolamentos sobre as linhas de água rc-
frigerada sempre são acondicionados com coletes com barreira
de vapor?
l4-62C Explicar como a pressão de vapor do ar ambiente é de-
tetminada quando a temperatura, a pressão total e a umidade
relativa do ar são dadas.
14-63 Considerar uma parede de tijolos de uma casa com
20 cm de espessura. As condições internas são 25 'C e 50Vo de
umidade relativa, enquanto as condições externas são 40 oC e
50Vo de umidade relativa. Supondo que não haja condensação
ou congelamento dentro da parede, determinar a quantidade de
umidade fluindo aEavés de uma unidade de superfície da parede
durante um período de 24 h.
14-54 Reconsiderar o balão discutido no Problema 14-53.
Supondo que o volume se mantenha constante e desconside-
rando a difusão de ar dentro do balão, obter uma relaçáo paru a
variação da pressão do balão com o tempo. Utilizando os resul-
tados obtidos e os valores numéricos que constam do problema,
determinar quanto tempo levará para que a pressão no interior
do balão desça para 100 kPa.
)/](https://image.slidesharecdn.com/engel-capitulo14-161107223251/85/cEngel-capitulo-14-59-320.jpg)

![do forno ele é de Dea=7,2 x 10 12
m2ls. Além disso, a fração de
massa de carbono na superfície exposta da peça de aço é man-
tida em 0,011 pelo ambiente rico em carbono no forno. Se o
processo de endurecimento deve continuar até que a fração de
massa do caÍbono em uma profundidade de 0,7 mm seja ele-
vada para O,32Vo, determinar quanto tempo a peça deverá ser
mantida no forno.
Resposta: 5,9 h
11-74 Repita o Problema 14*73 para uma temperatura do
tbrno de 500 K, na qual o coeficiente de difusão do carbono em
aço é DAB = 2,1 x l0 20
m2ls.
71-75 Uma lagoa com um teor de oxigênio inicial igual zero
deve ser oxigenada, formando uma tenda sobre a superfície da
água e enchendo-a com gás de oxigênio a 25 "C e 130 kPa.
Determinar a fração molar de oxigênio a uma profundidade de
1 cm da superfície após 24 h.
IIGURA P1+75
14-76 Uma longa barra de níquel, com um diâmetro de 5 cm,
foi armazenada em um ambiente rico em hidrogênio a 358 K e
300 kPa por um longo período de tempo e ela contém gás hi-
drogênio uniformemente distribuído em todo seu interior.
Agora, a barra é colocada em uma área bem ventilada de forma
que a concentração de hidrogênio na superfície externa perma-
nece quase zero o tempo todo. Determinar quanto tempo vai
levar para a concentração de hidrogênio no centro da barra cair
para a metade. O coeficiente de difusão do hidrogênio na barra
de níquel na temperatura ambiente de 298 K pode ser conside-
rado Do, = 1,2 x 10 12
m2ls.
Resposta:3,3 anos
DiÍusão em um meio em movimento
lÇ77C Definir os seguintes termos: velocidade média da massa,
velocidade de difusão, meio estacionário e meio em movimento.
l4-78C O que ó velocidade de difusão? Como ela afeta a ve-
locidade média da massa? A velocidade de uma espécie em um
meio em movimento em relação a um ponto de referência fixo
pode ser igual a zero em um meio em movimento? Explicar.
l4-79C Qual é a diferença entre a velocidade média da massa
e a velocidade média molar durante a transferência de massa
em um meio em movimento? Se uma destas velocidades é zero,
a outra também vai necessariamente ser zero? Em que condi-
ções essas duas velocidades vão ser as mesmas para uma mis-
tura binária?
14-80C Considerar a transferência de massa unidimensional
em um meio em movimento que consiste nas espécies A e B,
com p - Pe+ Ps = constante. Marcar estas declarações como
sendo Verdadeira ou Falsa.
-(a)
As taxas de difusão de massa das espécies A e B são
iguais em magnitude e em direção oposta.
-(b)
Dtn= Dnt.
-(c)
Durante o processo da contra difusão equimolar através
de um tubo, números iguais de mols de Á e B movem-se
em direções opostas e, assim, um dispositivo de me-
dida de velocidade colocado no tubo indicará zero.
-(d)
A tampa de um tanque contendo gás propano (que é
mais pesado do que o ar) é deixada aberta. Se o ar nos
arredores e o propano no tanque estão à mesma tem-
peratura e pressão, o propano não vai escapar e o ar
não vai entrar no tanque.
14-81C O que é escoamento de Stefan? Escrever a expressão
para a lei de Stefan e indicar o que representa cada variável.
L4-828 A pressão em tubulação que transporta gás hélio a uma
taxa de 5 1bm/s é mantida a 14,5 psia (libra por polegada qua-
drada absoluta) pela ventilação do hélio para a atmosfera através
de um tubo de t/t polegada de diâmetro interno, que se estende
por 30 pés no ar. Supondo que tanto o hélio quanto o ar atmosfé-
rico estão a 80 oF, determinar (a) avazáo mássica de hélio per-
dida para a atmosfera através do tubo, (b) a vazáo mássica de ar
que se infiltra nacanalízaçáo e (c) a velocidade do escoamento
no fundo do tubo onde este está ligado à tubulação que seria me-
dida por um anemômetro em operação permanente.
Ar
80 "F
14-83E Repetir o Problema 14-828 para uma tubulação que
transporta dióxido de carbono emvez de hélio.
14-84 Um tanque com uma cascade2 cmde espessura contém
gás de hidrogênio em condições atmosféricas de 25 "C e 90 kPa.
A váhrrla de carga do tanque tem um diâmetro intemo de 3 cm e
estende-se 8 cm acima do tanque. Se a tampa do tanque é deixada
aberta para que o hidrogênio e o ar possam sofrer uma contradifu-
são equimolar através da passagem de 10 cm de comprimento,
determinar avazáo mássica de hidrogênio que se perde pâra a at-
mosfera através da válwla na fase inicial do processo.
Resposta: 4,20 x 10 8 kgls
,]
FIGURA P14_82E](https://image.slidesharecdn.com/engel-capitulo14-161107223251/85/cEngel-capitulo-14-61-320.jpg)
![14-85 !ãI Reconsiderar o Problema 14-84. Usando o EES
EE ,ou outro program a),traçar avazáomássica do hi-
drogênio perdido em função do diâmetro da válvula de carga com
o diâmetro variando de 1 cm a 5 cm e discutir os resultados.
14-86E Um tubo de Stefan de 1 polegada de diâmetro é usado
para medir o coeficiente de difusão binária de vapor d'água no
ar a 80 "F e 13,8 psia (libra por polegada quadrada absoluta). O
tubo é parcialmente cheio de água com uma distância entre a
superfície daâgua e a extremidade aberta do tubo de 10 polega-
das. Ar seco é soprado sobre a extremidade aberta do tubo para
que o vapor d'âgra subindo ao topo seja removido imediata-
mente e a concentração de vapor na parte superior do tubo seja
zero. Durante 10 dias de operação contínua apressão e tempera-
tura constantes, a quantidade de água evaporada foi medida
como sendo 0,0025 lbm (libra massa). Determinar o coeficiente
de difusão de vapor d'água no ar a 80 "F e 13,8 psia.
14-87 Uma jarra de 8 cm de diâmetro interno e 30 cm de al-
tura, cheia até a metade de água, é deixada em uma sala seca a
15 'C e 87 kPa com o seu topo aberto. Se a água também é man-
tida a 15 oC
o tempo todo, determinar quanto tempo vai demo-
rar paÍa a ágtta evaporar completamente.
Resposta: 1 125 dias
FIGURA Pl4-87
14-88 Um grande reselatório contendo amônia a 1 atm e25 "C
é ventilado para a atmosfera através de um tubo de 2 m de compri-
mento cujo diâmetro interno é de 1,5 cm. Determinar a taxa de
perda de amônia e a taxa de infiltração de ar no reservatório.
Convecção de massa
14-89C A convecção de calor.é expressa pela lei de resfria-
mento de Newton como sendo Q = hA,(T, - Z-). Expressar a
convecção de massa de uma maneira análoga em uma base más-
sica, identificar todas as quantidades na expressão e estabelecer
as suas unidades.
1,1-90C O que é a camada limite de concentração? Como ela
é definida paÍa o escoamento sobre uma placa?
lÇglc Qual é o significado físico do número de Schmidr.- C.-,=-
ele é definido? Para qual número adimensional ele corre:p,..r,;= ';
transferência de calor? O que um número de Schmidt de 1 inÍ--.-
l4-92C Qual é o significado físico do número de Sher'r -'-,:'
Como ele é definido? Para qual número adimensionai e,e ; - -
responde na transferência de calor? O que um núro:r: -:
Sherwood de 1 indica para uma camada plana de fluido l
l4-93C Qual é o significado físico do número Les'is'C:-,,
ele é definido? O que um número de Lewis de 1 indica.'
l4-94C Na transferência de massa por convecção narÍj:1
número de Grashof é avaliado utilizando a diferença de c=-..-
dade em vez da diferença de temperatura. O número de Gr-.: :
avaliado desta forma também pode ser utilizado nos cál.-u-,:: -
transferência de calor?
l4-95C Usando a analogia entre transferência de cal.': : ::
massa, explicar como o coeficiente de transferência ,le ;:-.-.,,.
pode ser determinado a partir das relações para o coei-rci-::. ]
transferência de calor.
t4-96C É sabido que o ar quente sobe em um ambient: :--,
frio. Considere agora uma mistura quente de ar e i".---:-
(CsHrs) no topo de uma lata de gasolina. Você acha q!. =:-
mistura de gases irá subir em um ambiente mais frio.'
l4-97C Considerar duas xícaras de café idênticas. urL >:=
açúcar e a outra cheia de açúcar no fundo. Iniciakng113. r- i.,'
os copos estão na mesma temperatura. Se forem delra;... =:-
vigilância, qual xícara de café vai esfriar mais rápido?
l4-98C Em que condições as camadas limite normatiz";.. :i
velocidade, da temperatura e da concentração coinci,je:- :--
rante o escoamento sobre uma placa plana?
l4-99C Como a relação (fl2')Re = Nu = Sh é conhecic' =-
que condições ela é válida? Qual é sua importância prári;,
14-100C Qual é o nome da relaçáofl2 - St Pr2/r = Sr_=..-S::
e quais são os nomes das variáveis dela? Em que condi;ie. :-l
é válida? Qual é a importância dela na engenharia?
14-101C Como a relação h.*o,= pcnh^n"u é conhecida? Pa.r: ;-r
tipos de misturas ela é viáüda? Qual é a importância prática oe-=
-
l4-102C O que é a aproximação de baixo fluxo de rrii: 1
análise da transferência de massa? A evaporação da águ: à -
lago pode ser tratada como um processo de baixo fluxo de r -.-
14-103 O ar a 40 oC e I atm escoa ao longo de um: :-.:i
molhada de 5 m de comprimento com uma velocidade me:-= -
2,5 nls, a fim de secar a superfície. Usando a analogie ::=.
transferência de calor e de massa, determinar o coet-ru-rür,:i
=
transferência de massa da placa.
14-104E Considerar um tubo circular de diâmetro ine= -- =
0,7 pol cuja superfície interna é coberta por uma fina ;,.;r1" -
água líquida, como resultado da condensação. A fim de =;;-- .
tubo, ar a 540 R e I atm é forçado a fluir através dele .-.':i -;
velocidade média de 6 pés/s. Usando a analogia Êo[3 -i::v
ferência de calor e de massa, determinar o coeflciente de :r.:=-
Vapor de](https://image.slidesharecdn.com/engel-capitulo14-161107223251/85/cEngel-capitulo-14-62-320.jpg)



