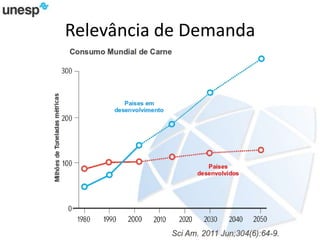
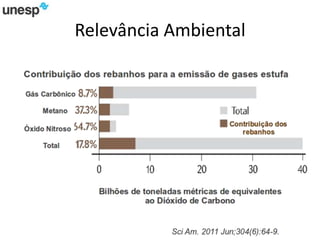
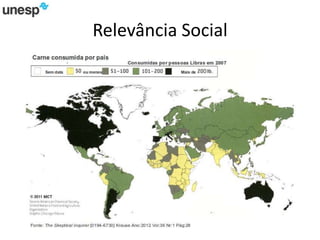
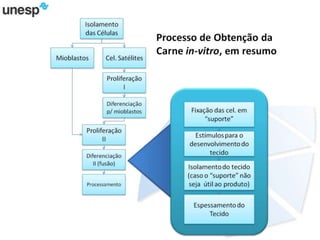
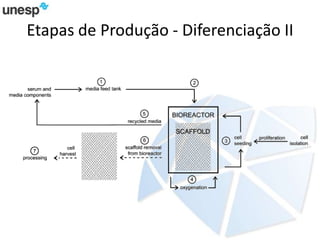
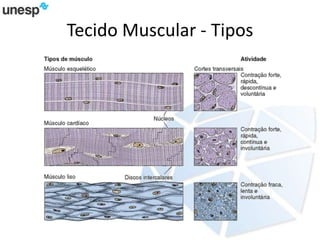
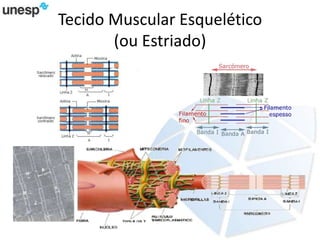
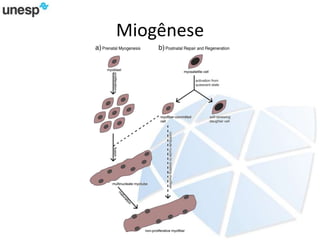
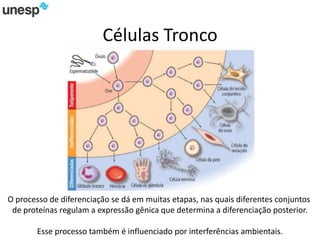
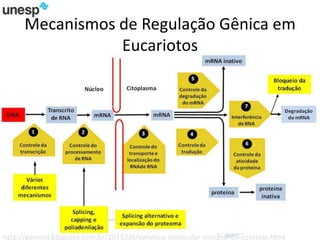
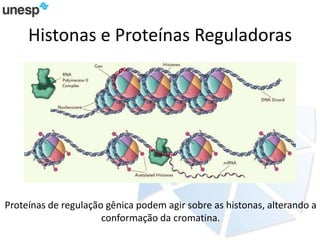
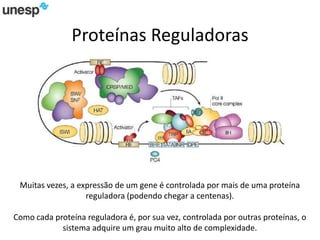
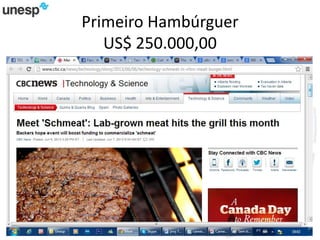
O documento discute a produção de carne in vitro, resumindo suas principais etapas: 1) Proliferação de células-tronco ou satélites musculares; 2) Diferenciação das células em mioblastos; 3) Fusão dos mioblastos em fibras musculares através de estímulos químicos e mecânicos. Desafios incluem desenvolver meios de cultura e fatores de crescimento viáveis economicamente, e sistemas para promover a contração e vascularização do tecido muscular.