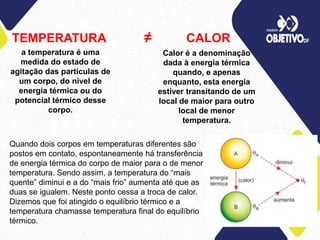
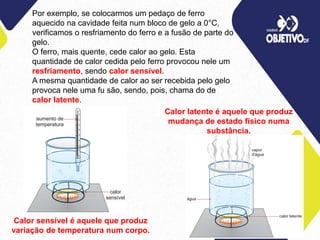
1) O documento discute os conceitos de calorimetria, incluindo a transferência de calor entre corpos de diferentes temperaturas e os efeitos do calor sensível e latente.
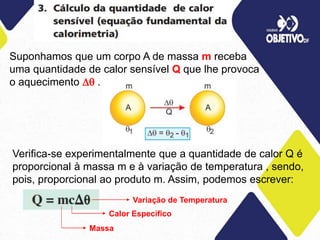
2) É introduzida a equação fundamental da calorimetria que relaciona a quantidade de calor, massa, calor específico e variação de temperatura.
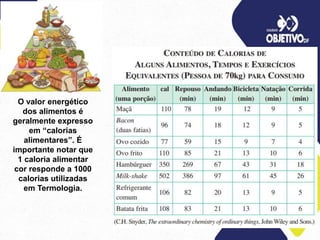
3) Unidades como caloria e joule são definidas no contexto de medição de energia térmica.