O documento fornece 110 itens verdadeiros sobre química geral para a UFSC, incluindo definições de elementos químicos, propriedades atômicas, tipos de ligação, ácidos e bases, equilíbrio químico e reações químicas. O documento é um resumo de conteúdos importantes para estudantes que irão prestar o vestibular da UFSC.













![
110 itens verdadeiras para UFSC
• 79 ↑T desloca o equilíbrio p/ lado (DH = +) endotérmico.
• 80 ↑p desloca o equilíbrio p/ lado de menor volume
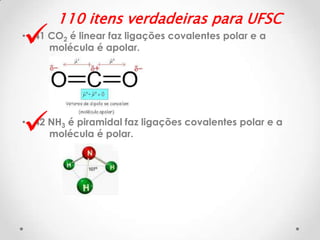
• 81 N2(g) + 3H2(g) ↔ 2NH3(g)
Kc= __[NH3]2
[N2][H2]3
• 82 Carbono saturado (sp3), tetraédrico, 109º 28'; (4s ).
• 83 Carbono insaturado (sp2), trigonal planar, 120º (3s e
1p).
• 84 Carbono insaturado (sp), linear, 180º (2s e 2p).
• 85 Cadeias abertas, acíclicas, alifáticas.](https://image.slidesharecdn.com/aulofinal2013-131209192338-phpapp01/85/Aulao-UFSC-2014-17-320.jpg)




