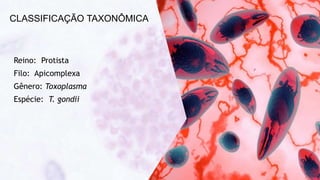
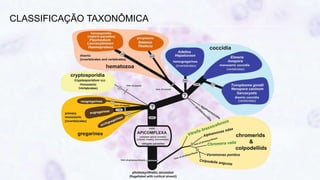
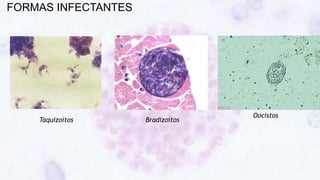
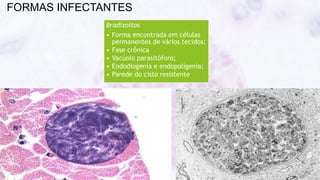
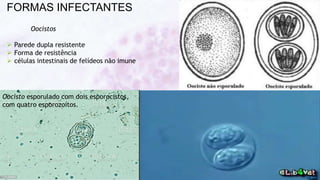
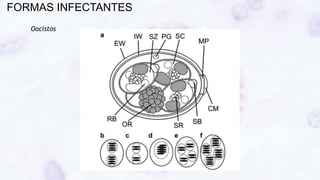
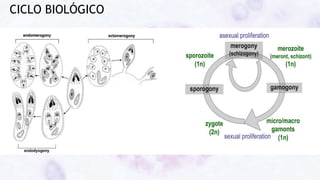
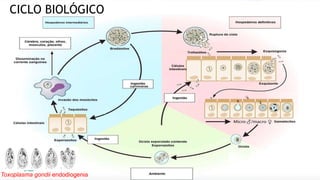
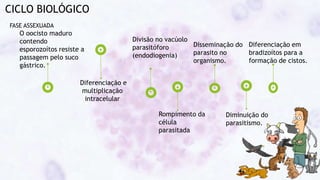
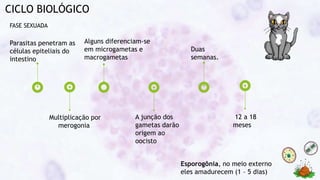
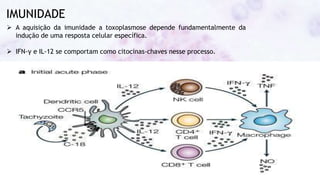
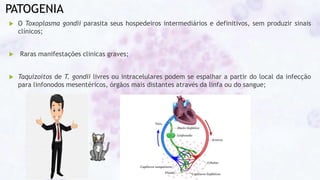
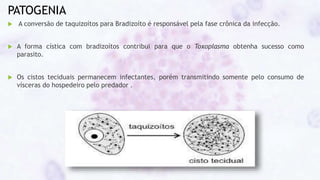
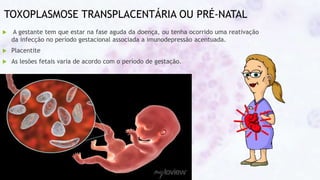
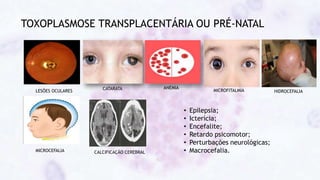
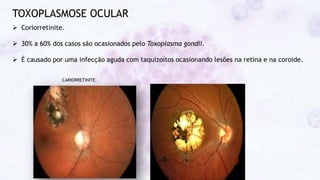
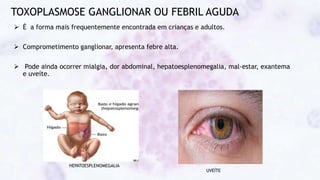
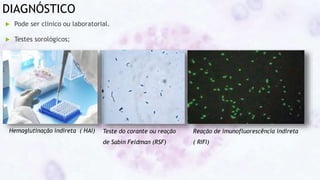
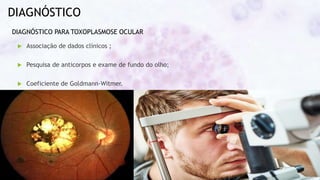
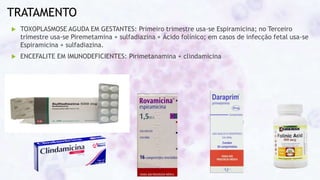
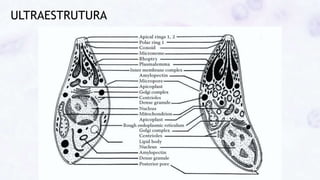
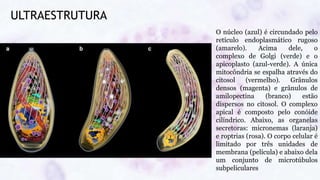
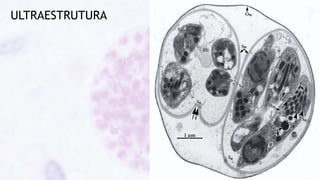
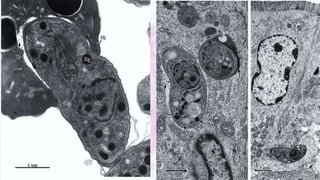
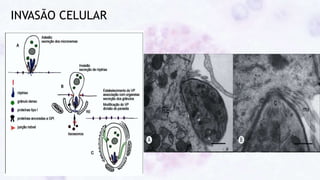
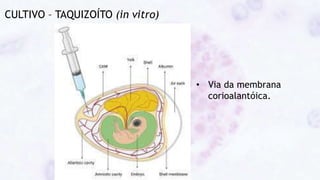
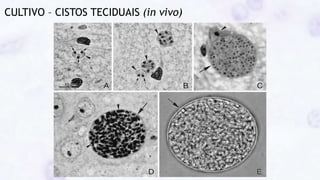
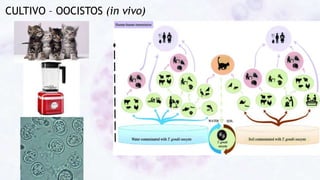
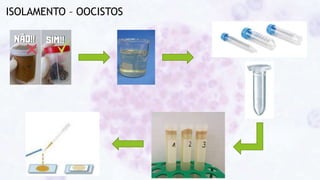
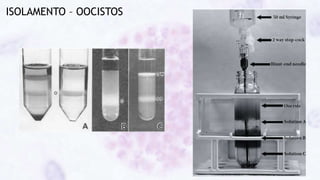
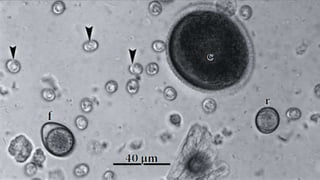
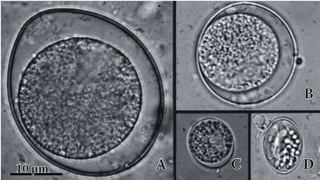
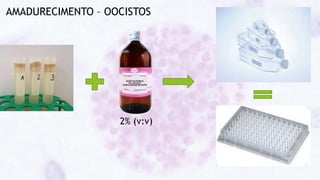
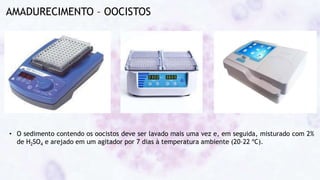
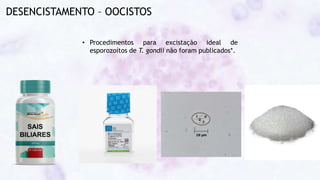
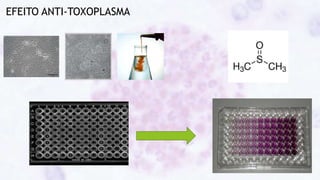
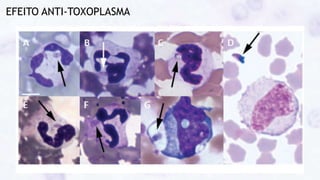
Este documento fornece um resumo sobre a parasitologia do protozoário Toxoplasma gondii. Aborda tópicos como classificação taxonômica, histórico, morfologia, formas infectantes, ciclo biológico, transmissão, imunidade, patogenia, diagnóstico, epidemiologia, tratamento e profilaxia.