O documento discute conceitos de química inorgânica como óxidos, sais, ácidos e bases. O estudante responde perguntas sobre essas definições e conceitos, incluindo exemplos de óxidos no dia a dia, diferenças entre óxidos, peróxidos e superóxidos, classificação de óxidos, tipos de reações para formação de sais e propriedades dos mesmos. Teorias como as de Werner, Blomstrand-Jorgensen e dos 18 elétrons também são abordadas.



![• Compostos iônicos com ligações iônicas que geralmente formam
estruturas cristalinas fortes;
• Estado físico sólido devido à força das ligações, formando
estruturas compactas.
13) Cite algumas propriedades dos elementos de transição.
Resposta:
14) Diferencie elementos de transição externa de elementos de
transição interna.
Resposta: Dos elementos de transição, os que apresentam orbitais d
incompletos são conhecidos como elementos de transição externa ou,
simplesmente, elementos de transição, enquanto os que apresentam orbitais f
incompletos são chamados elementos de transição interna. Essa denominação
deve-se ao fato dos orbitais f incompletos ficarem abaixo dos orbitais d, sendo,
portanto, internos em relação ao nível de valência do átomo.
15) Escreva o nome dos compostos:
a) [Co(NH3)]Cl3 = Cloreto de aminocobalto(III)
b) [Mo(H2O)]Cl3 = Cloreto de aquomolibidênio
c) [Fe(CO)5] = Pentacarbonilferro(0)
d) [Ni(CO)4] = Tetracarbonilníquel(0)
16) Explique de maneira sucinta a teoria de Werner,
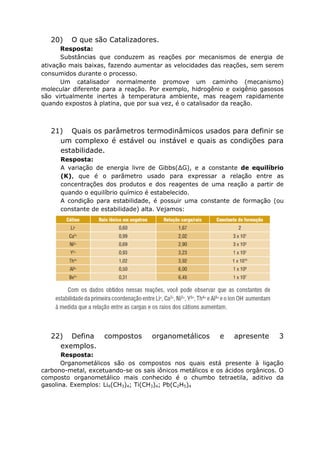
Blomstrand –Jorgensen e a regra dos 18 elétrons.
Resposta:
TEORIA DE BLOMSTRAND-JORGENSEN
Em 1858, Kekulé lançou uma teoria sobre a estrutura dos compostos
orgânicos, propondo que, nessas substâncias, os átomos de carbono formavam
cadeias de grupos CH2.](https://image.slidesharecdn.com/estudodirigido-andreaugusto-140504135350-phpapp01/85/Estudo-dirigido-Diversidade-Quimica-EAD-4-320.jpg)
![Raciocinando da mesma forma, e admitindo que o nitrogênio pudesse
assumir valência igual a cinco, Blomstrand e Jorgensen, em 1871, propuseram
que nos compostos de coordenação haveria encadeamento semelhante ao
verificado nos compostos orgânicos.
TEORIA DE WERNER
As proposições lançadas por Werner, constituintes de sua teoria, podem
ser resumidas nos seguintes postulados:
a) A maioria dos elementos possui uma valência primária, relacionada ao
número de oxidação, e uma valência secundária, relacionada ao número de
coordenação.
b) Todos os elementos tendem a satisfazer tanto às valências primárias
quanto às valências secundárias.
c) As valências secundárias estão dirigidas para posições fixas no espaço.
TEORIA DOS 18 ELÉTRONS
"Os complexos adquirem estabilidade quando o número atômico efetivo do
átomo central iguala-se ao número atômico de um gás nobre."
***Tal condição faz lembrar a regra do octeto, razão pela qual também é conhecida como
regra dos dezoito elétrons, pois, ressalvadas as muitas espécies em que essas regras não são
observadas, em ambas os números de elétrons de valência são iguais aos dos gases nobres.
17) Explique a teoria do Campo cristalino e exemplifique.
Resposta:
• Modelo Eletrostático:
– Prediz que os orbitais d em um complexo metálico não são
degenerados (ou seja, não possuem a mesma energia).
– O desdobramento energético dos orbitais d depende do campo
cristalino (i.e. o arranjo e o tipo dos ligantes)
• Os ligantes criam um campo elétrico em torno do metal:
– Os ligantes são considerados cargas pontuais e não apresentam
interações covalentes com os metais.
Em cada complexo ou aduto resultante dessas interações, os ligantes, posicionados em
torno do átomo ou íon central, formam o campo cristalino da espécie química
produzida. Esse campo é o fator determinante da diferenciação de energia entre os
orbitais d da espécie considerada, e os mecanismos imaginados para explicar as
interações entre os ligantes e os orbitais d constituem a teoria do campo cristalino
(TCC).
Para um exemplo geral: My+
+ xL → [MLx]y+
onde, My+
representa o cátion metálico, L o
ligante e [MLx]y+
é o íon complexo formado.](https://image.slidesharecdn.com/estudodirigido-andreaugusto-140504135350-phpapp01/85/Estudo-dirigido-Diversidade-Quimica-EAD-5-320.jpg)