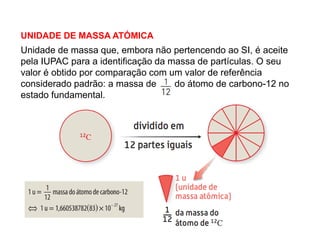
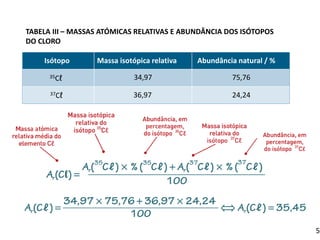
Unidade de massa atômica e definição de massa isotópica e massa atômica relativa média. Cálculo da abundância natural de isótopos e determinação da massa isotópica relativa a partir da massa atômica média de um elemento. Resolução de exercícios para consolidação dos conceitos.