aula 9- PROTEINAS simplificada
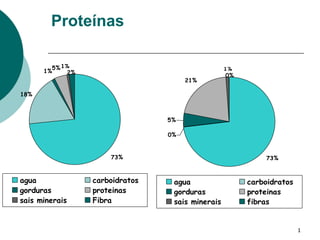
- 1. Proteínas 5% 1% 1% 1% 2% 0% 21% 18% 5% 0% 73% 73% agua carboidratos agua carboidratos gorduras proteinas gorduras proteinas sais minerais Fibra sais minerais fibras 1
- 2. Proteinas 2
- 3. Proteínas Caracterização estrutura propriedades análise em alimentos 3
- 4. Introdução Componentes essenciais a todas as células vivas, relacionadas a todas as funções biológicas Contrateis (miosina, actina) Estrutural (colágeno /queratina) Biocatalizadores (enzimas) Hormonais (insulina, hormônios da tireóide) Transferência ( hemoglobinas e transferinas) Reserva (ovoalbumina, caseína) Proteção contra agressores Responsaveis por DOA Botulismo (toxina botulinica) Encefalopatias espongiformes (Prios) 4
- 5. PROTEINAS ALIMENTÍCIAS OVO CLARA OVALBUMINA (50%) CONALBUMINA OVOMUCINA AVIDINA LIZOSIMA GEMA LIPOVITELINA E FOSFOVITINA LEVITINA 5
- 6. PROTEINAS ALIMENTÍCIAS TRIGO Prolaminas Glutelinas Glutem: prolaminas +glutelinas Responsavel pela textura dos pães 6
- 7. PROTEINAS ALIMENTÍCIAS CARNE –estrutura complexa e fibrosa Miosina-actina Colageno (gelatina) 7
- 8. PROTEINAS ALIMENTÍCIAS LEITE CASEINA – FOSFOPROTEINA (80%) LACTOALBUMINA (0,5%) LACTOGLOBULINA (0,2%) 8
- 9. Quimicamente falando: o que são proteínas Polímeros de alto peso molecular formados por cadeias de aminoácidos, unidos entre si por ligações peptídicas Ate 10 aminoácidos = peptídeo > 10 aminoácidos = proteínas 9
- 10. Aminoácidos Unidades estruturais básicas das proteínas, ligadas entre si por ligações peptídicas Radical diferenciador 10
- 11. AMINOÁCIDOS Ligação peptídica 11
- 12. Compostos heteropolimétricos 12
- 13. Estrutura e conformação das Proteínas PRIMARIA LINEAR – seqüência dos AA SECUNDÁRIA Pregueada Hélice TERCIARIA Dobras e enrolamentos da cadeia QUATERNARIA Duas ou mais cadeias peptídicas 13
- 14. Estruturas das proteinas Primária Secundária Terciária Quaternária 14
- 15. Classificação quanto a solubilidade Proteinas fibrosas: São aquelas que apresentam moléculas distendidas e filamentosas, semelhantes a longos fios. E são insolúveis em água. Colágeno e fibrina são exemplos de proteínas fibrosas. Proteínas globulares: Apresentam as moléculas enroladas como novelos e são solúveis em água formando micelas. A maioria das proteínas apresentam estrutura globular como, por exemplo, as enzimas, anticorpos, hemoglobina, clorofila e proteínas estruturais. 15
- 16. Radical Confere identidade aos AA 16
- 17. Classificação dos Aminoácidos Segundo a polaridade dos seus radicais "R“ Apolares ou hidrófobos Polares: R sem carga Polares positivos Polares negativos 17
- 18. Forma Dipolar dos Aminoácidos Em solução aquosa são ANFÓTEROS pois,, comportam-se como ácido e como base, formando ÍONS DIPOLARES, a saber: NH3+ R C COO - H 18
- 19. AÇÃO DO PH DA SOLUÇÃO meio ácido, + H+, comportando-se como base AA + H+ AA+ Meio básico, - H+, comportando-se como ácidos AA + OH- AA- Ponto isoelétrico: valor de pH onde as cargas elétricas do aminoácido se igualam e se anulam: AA+- =pH 6 19
- 20. Propriedades funcionais- derivadas das propriedades fisico- quimicas Confere Características especiais de textura e viscosidade 20
- 21. PRINCIPAIS PROPRIEDADES FÍSICO-QUÍMICAS PROMOTORES DE VISCOSIDADE Hidratação = solubilidade em água Aceitabilidade sensorial dos alimentos Textura, maciez Rápida dispersão Homogeneidade Molhos Sopas desidratadas Pures bebidas 21
- 22. PRINCIPAIS PROPRIEDADES FÍSICO-QUÍMICAS PROMOTORES DE GELEIFICAÇAO Rede de proteínas Produtos lacteos: 22Queijos e iogurtes Gelatinas Necessário desnaturação + agregação Proteina-proteina Tratamento térmico Hidrolise enzimática Acidificação ou alcalinização Ex:Produção de queijos 22
- 23. VALOR BIOLÓGICO ALTO VALOR BIOLÓGICO: PROTEÍNAS COMPLETAS, OU SEJA, CONTÊM TODOS OS AMINOÁCIDOS QUE O CORPO PRECISA. ORIGEM ANIMAL, COMO AS CARNES(QUALQUER TIPO), OS OVOS, O LEITE, IOGURTE E O QUEIJO. BAIXO VALOR BIOLÓGICO: NÃO CONTEM TODOS OS AMINOÁCIDOS ESSENCIAIS ORIGEM VEGETAIS 23
- 24. AA não essenciais = produzidos pelo organismo não-essenciais: alanina asparagina ácido aspártico cisteína ácido glutâmico glutamina (sintetizada a partir do ácido glutâmico = glutamato) glicina prolina triosina 24
- 25. AA essenciais= não produzidos pelo organismo – devem ser ingeridos essenciais: histidina isoleucina leucina lisina metionina fenilalanina treonina triptofano valina Arginina serina 25
- 26. Desnaturação As proteínas podem desnaturar. Isto acontece quando, por ação de substâncias químicas ou do calor, as proteínas sofrem alteração da estrutura terciária ou a quebra das ligações não covalentes da estrutura quaternária. As proteínas perdem a sua conformação e, consequentemente, a sua funcionalidade. A desnaturação pode ser: reversível ou irreversível. 26
- 27. DESNATURAÇÃO PROTEICA ALTERAÇAO NA CONFORMAÇAO ESTRUTURAL (secundaria, terciária ou quaternária) Não afeta a digestibilidade EFEITOS DA DESNATURAÇÃO Redução na solubilidade Dificuldade de Cristalização Perda de atividade biológica (enzimática ou imunológica) Aumento da reatividade química Aumenta da viscosidade intrínseca CAUSAS: FATORES FISICOS E QUIMICOS Calor / congelamento Agitação mecânica severa Radiações Ácidos e bases – pH – ponto isoelétrico insolubilização 27
- 28. Determinação de proteínas em alimentos Método de kjeldahl 1. Digestão da matéria orgânica com acido sulfúrico Matéria orgânica +H2SO4 Sulfato de amônio (N proteico) 2. Destilação: transferência da amônia (N proteico) para uma solução acida conhecida Sulfato de amônio + NaOH Na2SO4 + NH3 NH3 + H2SO4 NH4 + H2SO4 28
- 29. METODO KJELDHAL - CONTINUAÇAO 3. Titulação Quantificação do amônio através da quantificação do excesso de acido sulfúrico (2) mediante titulação com hidróxido de sódio Cálculos: transformação do N proteico em proteína Fator de correção: 6,25 %P= (H2SO4 que reagiu).f.100.6,25/amostra 29
- 30. REFERENCIAS BIBLIOGRAFICAS BIBBIO,F. e BOBBIO, P. Introdução a Química de Alimentos.Campinas, Fundação Cargil, 1985, 306p. PEARSON, D. The Chemical Analysis of Food. London: Chemical Pubishing CO, 1076,331p. Ordòñez, A. J. Tecnologia de alimentos- Componentes –Processos. vol 1, 2005 30