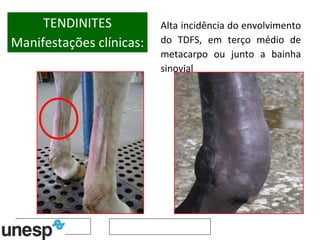
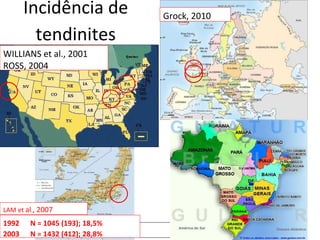
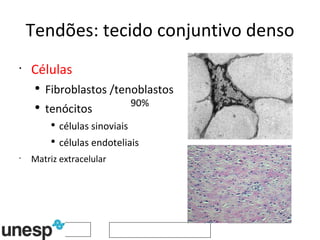
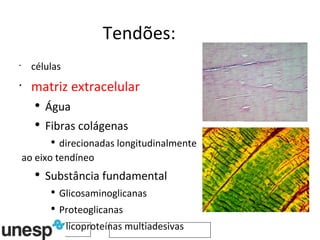
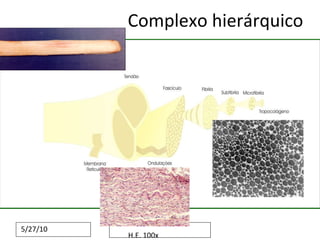
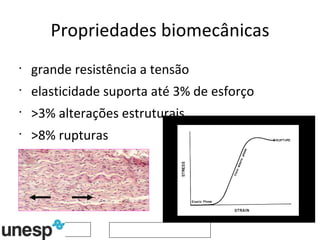
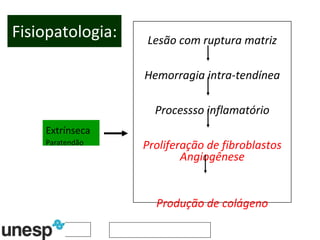
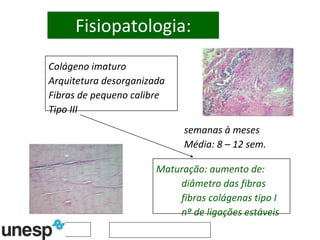
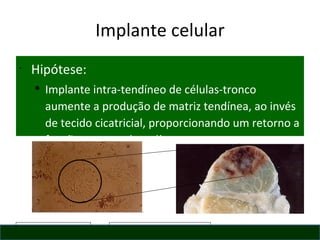
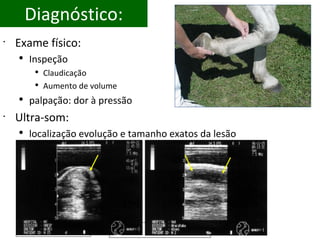
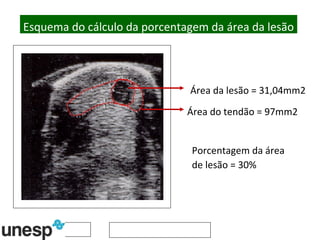
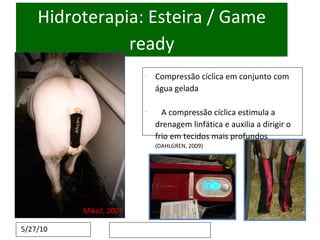
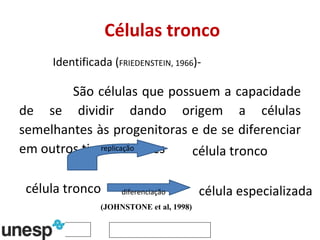
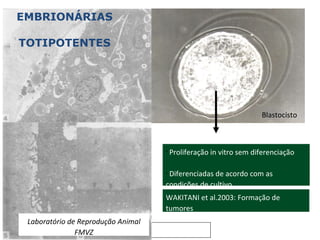
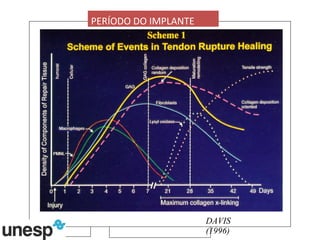
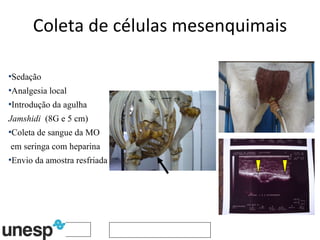
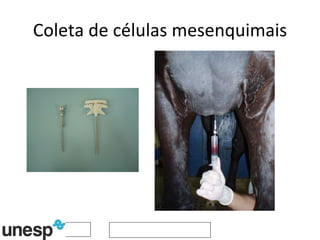
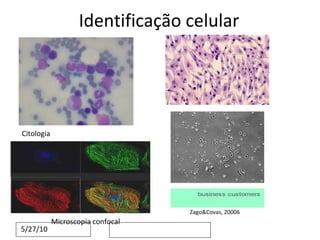
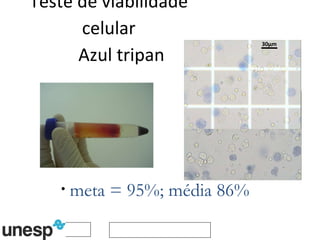
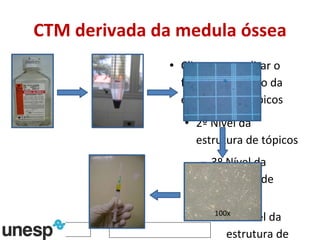
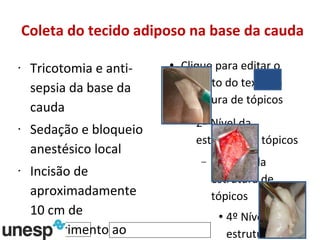
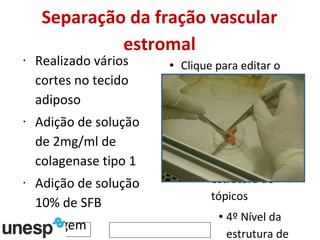
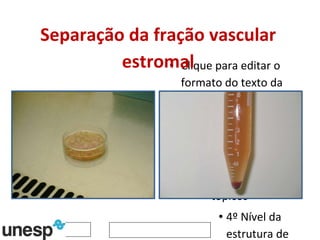
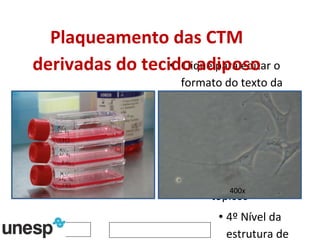
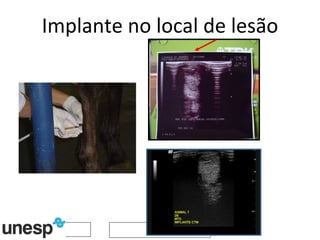
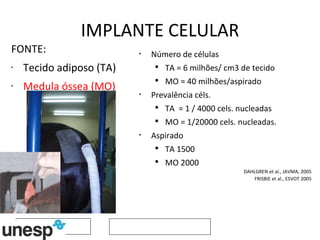
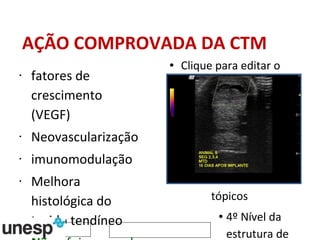
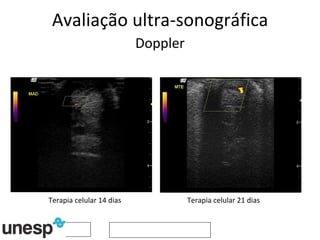
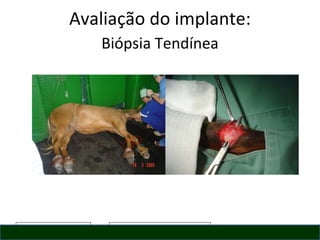
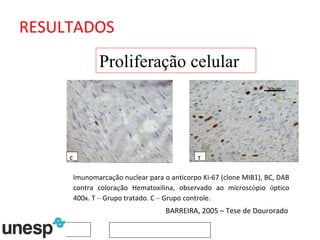
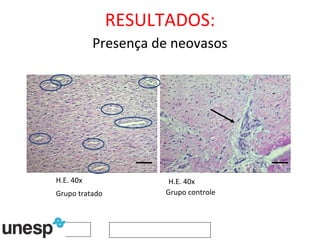
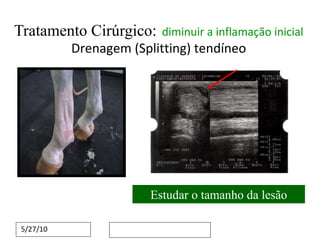
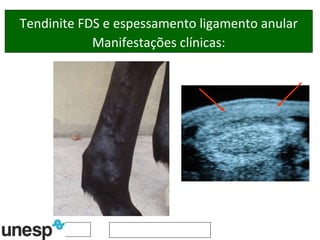
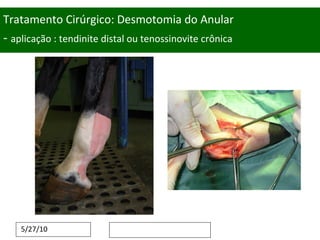
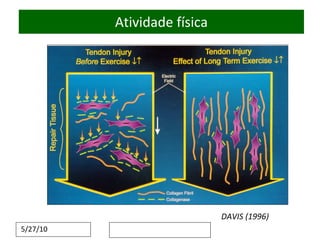
O documento discute o potencial da terapia celular, especialmente células-tronco mesenquimais, no tratamento de tendinite equina. As células-tronco mesenquimais podem ser isoladas da medula óssea ou tecido adiposo e cultivadas para implante no local da lesão, onde podem promover neovascularização, melhorar a qualidade do tecido tendíneo e acelerar a cicatrização através de fatores de crescimento liberados. Os resultados iniciais sugerem que a terapia celular associada ao plasma r

![Terapia celular no tratamento de tendinite equina Profa. Dra. Ana Liz Garcia Alves Departamento de Cirurgia e Anestesiologia Veterinária Email: [email_address]](https://image.slidesharecdn.com/tendinite-em-equinos02-100527184459-phpapp02/85/Tratamento-de-tendinite-equina-com-celulas-tronco-2-320.jpg)