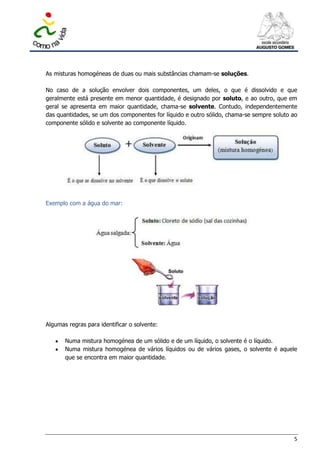
Este documento descreve uma visita de estudo de alunos do 7o ano à Praia do Aterro em Matosinhos. O documento discute os vários materiais encontrados na praia, como rochas, areia e plástico, e classifica-os como naturais, sintéticos ou manufaturados. Também explica como os materiais podem ser classificados como substâncias ou misturas, e discute as propriedades dos três estados físicos da matéria - sólido, líquido e gasoso.