O documento discute conceitos fundamentais de calorimetria e trocas de calor, incluindo:
1) Calor é energia transferida devido à diferença de temperatura entre corpos;
2) A capacidade térmica indica a quantidade de calor necessária para variar a temperatura de um corpo, enquanto o calor específico leva em conta também a massa do corpo;
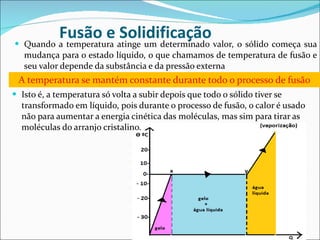
3) Existem calores sensível, latente e de mudança de estado, necessários para processos como fusão, vaporização e liquefação.