1. O documento contém uma ficha de avaliação com perguntas sobre constituição da matéria, reações químicas, propriedades dos ácidos e bases e fatores que influenciam a velocidade das reações.
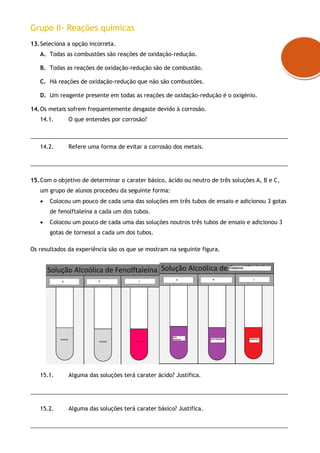
2. As perguntas incluem identificar estados físicos, representar átomos e moléculas, balancear equações químicas e determinar se soluções são ácidas, básicas ou neutras.
3. Fatores como concentração dos reagentes e temperatura influenciam a velocidade das reações químicas