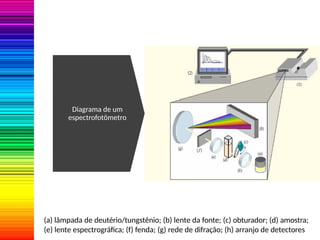
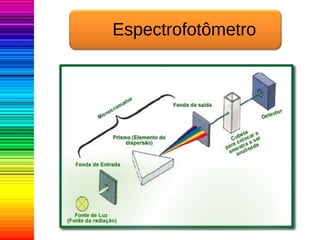
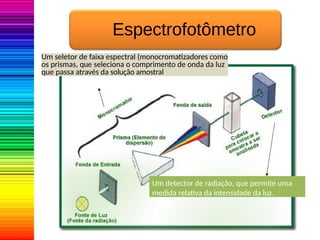
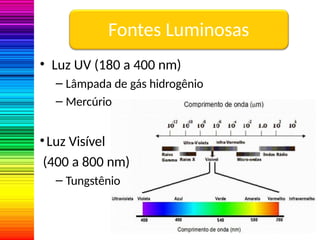
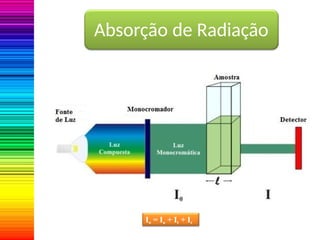
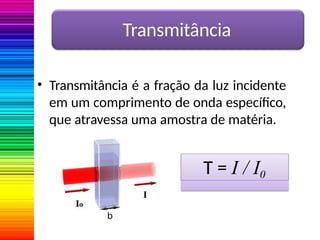
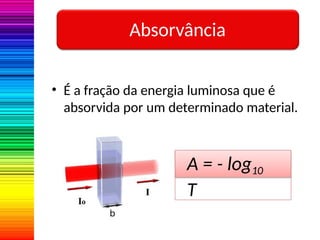
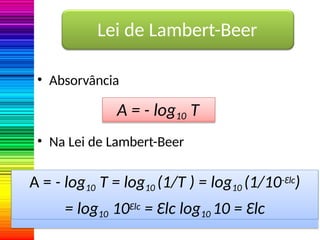
A espectrofotometria é um método de análise quantitativa baseado na absorção de radiação eletromagnética, principalmente nas faixas de luz visível e ultravioleta. O espectrofotômetro mede a intensidade da luz absorvida por uma substância e relaciona essa absorvância à concentração do material presente na solução, conforme a lei de Lambert-Beer. A curva padrão, obtida por medições de absorvância em soluções conhecidas, permite determinar quantitativamente a concentração de solutos em amostras.













![Lei de Lambert-Beer
Curva padrão
0,0000
0,0
0,0020
0,0040
0,0060
0,0080
0,0100
0,1 0,1 0,2 0,2 0,3 0,3 0,4 0,4
Curva Padrão A equação da reta é dada por:
Y= a.(x)+ b
Y= 0,0026.(x) + 0,0002
0,5
[ ]
Abs
0,0120
Com a curva padrão, obtendo o valor da absorvância por meio do
espectrofotômetro podemos determinar a concentração do soluto a partir
da equação da reta.
a
a = tg = y2-y1
x2-x1](https://image.slidesharecdn.com/espectrofotometria-250108013316-32e4922a/85/espectroscopia-de-solucoes-aquosas-e-solidos-26-320.jpg)
![Lei de Lambert-Beer
Curva padrão
0,0000
0,0
0,0020
0,0040
0,0060
0,0080
0,0100
0,1 0,1 0,2 0,2 0,3 0,3 0,4 0,4
Curva Padrão A equação da reta é dada por:
Y= a.(x)+ b
Y= 0,0026.(x) + 0,0002
0,5
[ ]
Abs
0,0120
A inclinação da reta (a) é portanto o coeficiente de extinção () da Lei
de
Lambert-Beer.
A = . l . c
a
a = tg = y2-y1
x2-x1](https://image.slidesharecdn.com/espectrofotometria-250108013316-32e4922a/85/espectroscopia-de-solucoes-aquosas-e-solidos-27-320.jpg)