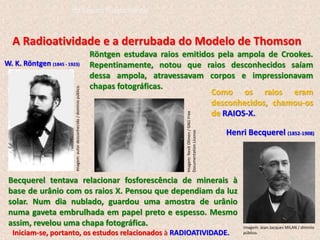
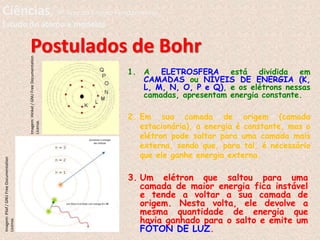
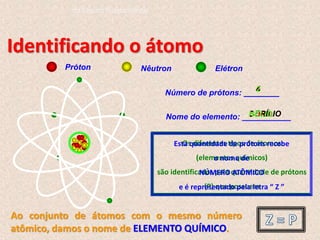
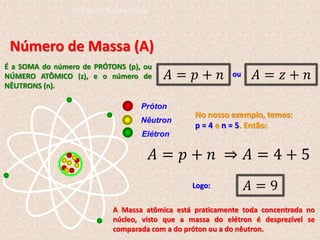
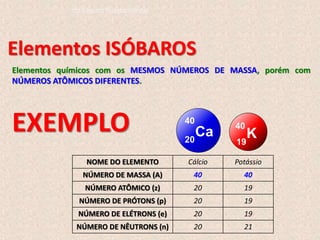
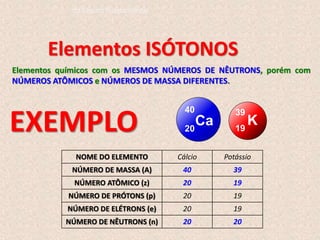
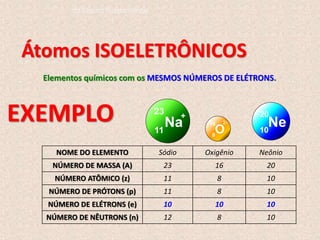
O documento descreve a evolução dos modelos atômicos ao longo do tempo, começando pelo modelo de Dalton, passando pelo modelo de Thomson, e culminando no modelo atômico moderno. Os principais modelos descritos são o de Rutherford, que introduziu o conceito de núcleo atômico, e o de Bohr, que postulou que os elétrons orbitam o núcleo em níveis de energia discretos. O documento também discute contribuições importantes como a descoberta do nêutron por Chadwick e o princípio da dual