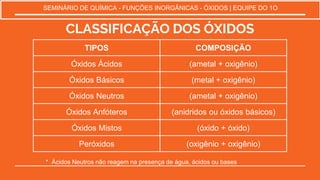
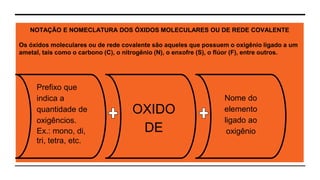
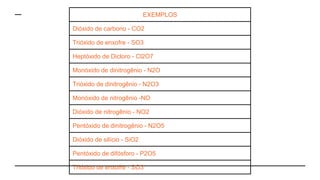
O documento discute as propriedades e classificação dos óxidos. São descritos seis tipos principais de óxidos: ácidos, básicos, neutros, anfóteros, mistos e peróxidos. Exemplos representativos de cada tipo são fornecidos, juntamente com suas fórmulas químicas e características. A notação e nomenclatura dos óxidos moleculares também são explicadas.